
【题目】在标准状况下,两种气态烃的混合物密度为1.14g·L-1,则对此混合物组成说法正确的是
A. 一定没有甲烷 B. 一定没有乙烷
C. 可能是甲烷和乙烷的混合物 D. 可能是乙烷和乙烯的混合物
科目:高中化学 来源: 题型:
【题目】下列有关原子轨道的叙述中正确的是
A. 硫原子的2s轨道能量较3p轨道高
B. 能层n=4的原子轨道最多可容纳16个电子
C. 铯原子的2s与5s 轨道均为球形
D. p能级的原子轨道呈哑铃形,随着能层序数的增加,p能级原子轨道也在增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铍和铝的性质相似,下列关于铍的推断中,正确的是( )
A.铍与铝在周期表中处在同一主族
B.氢氧化铍可以溶于水
C.氧化铍既可以与强酸反应,又可以与强碱反应
D.氯化铍的化学式为BeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用FeSO4还原MnO4-,若还原5×10-3 mol MnO4-,消耗10 mL 2.5 mol·L-1 FeSO4溶液,则Mn元素在还原产物中的化合价是
A. +1 B. +2
C. +4 D. +5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压代替平衡浓度计算,分压=总压×物质的量分数.在恒温恒压条件下,总压不变,用平衡分压计算平衡常数更方便.下列说法不正确的是( )
A.对于C2H4 (g)+H2O(g)?C2H5OH(g),在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为2 mol,则用分压表示的平衡常数Kp= ![]()
B.恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)?2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3mol N2 , 则平衡正向移动
C.恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和 C的物质的量分别为4mol、2mol和4mol,若此时A、B和C均减少1 mol,平衡逆向移动
D.对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种光化学电池的结构如图所示,电池总反应为:AgCl(s)+Cu+(aq)===Ag(s)+Cu2+(aq)+Cl-(aq),下列关于该电池在工作时的说法中正确的是
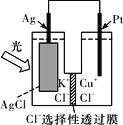
A. 生成108 g银,转移电子个数为1 mol
B. Cu+在负极发生氧化反应
C. Ag电极活泼,Ag失电子发生氧化反应
D. Cl-由负极迁移到正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)写出下列物质的电离方程式:
Ba(OH)2;
Fe2(SO4)3;
H2SO4 .
(2)如果NaHSO4的电离方程式可以写成:NaHSO4=Na++H++SO42﹣ . 那么,将NaHSO4溶液与氢氧化钠溶液完全反应的离子方程式是: .
(3)用“双线桥”法,对反应MnO2+4HCl=MnCl2+Cl2+2H2O进行化合价变化、电子转移以及氧化、还原分析. , 其中氧化剂是 , 还原剂是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2(g)+3H2(g) ![]() 2NH3(g),现向一密闭容器中充入1molN2和3molH2 , 在高温、高压和催化剂存在条件下发生反应.下列有关说法正确的是( )
2NH3(g),现向一密闭容器中充入1molN2和3molH2 , 在高温、高压和催化剂存在条件下发生反应.下列有关说法正确的是( )
A.最终可以生成2molNH3
B.达到化学平衡状态时,正反应和逆反应的速率都为0
C.达到化学平衡状态时,容器中N2、H2和NH3的物质的量之比为1:3:2
D.达到化学平衡状态时,N2、H2和NH3的物质的量浓度不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com