
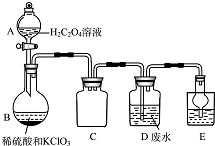
 ClO2��һ�ֹ����Ϲ��ϵİ�ȫ������ɫˮ���������ش��������⣺
ClO2��һ�ֹ����Ϲ��ϵİ�ȫ������ɫˮ���������ش��������⣺���� ��1������Ϥ��������״˵�������ƣ�����Cװ�ý����ܡ������ܶ��϶̿�֪Ϊ��ȫƿ����ֹ������
�����ݷ�Ӧ���ɵIJ����ϡ�ClO2�ױ�ը�����á��������塱��ϡ��ʱ����ը�����͡����
�۶������Ⱦ���ǿ�������ԣ��ܹ������������������ɶ������̣���������ԭΪ�����ӣ�
�����ݶ������ȼ�������ˮ�ܹ����������Ʒ�Ӧ�����ʽ��
��2�������ݸ�����ز��ȶ������ֽ�����ʽ�𣻸��������CN-����������ԭ��Ӧ������ԭΪ��ɫ�Ķ��������ӣ����Ե��ﵽ�ζ��յ�ʱ����ɫ����ɫ��Ϊ�Ϻ�ɫ���Ұ�����ڲ���ɫ��
�����ݷ���ʽ��2MnO4-+8H++2CN-=2Mn2++2CO2+N2+4H2O���㣻
������C��=$\frac{C��V��}{V��}$������������
��� �⣻��1����Aװ�õ������Ƿ�Һ©��������Cװ�ý����ܡ������ܶ��϶̿�֪Ϊ��ȫƿ����ֹ������
�ʴ�Ϊ����Һ©���� ��������
����H2C204��Һ��ϡ�����KC103�Ʊ�ClO2��Ӧ����Ϊ�������ȡ�������̼��ϡ��Cl02����ͱ�ը�Ŀ����ԣ�
�ʴ�Ϊ���Ƶ�Cl02��ͬʱ��CO2��������ϡ��Cl02����ͱ�ը�Ŀ����ԣ�
�۶������Ⱦ���ǿ�������ԣ��ܹ������������������ɶ������̣���������ԭΪ�����ӣ����ӷ���ʽ��2ClO2+5 Mn2++6H2O=5 MnO2��+2 Cl-+12H+��
�ʴ�Ϊ��2ClO2+5 Mn2++6H2O=5 MnO2��+2 Cl-+12H+��
�ܶ������ȼ�������ˮ�ܹ����������Ʒ�Ӧ�����Կ�����ˮ��������������Һ���չ����Ķ������ȣ�
�ʴ�Ϊ��b��d��
��2���ٸ�����ز��ȶ������ֽ⣬����Ӧ������ɫƿ�У����������CN-����������ԭ��Ӧ������ԭΪ��ɫ�Ķ��������ӣ����Ե��ﵽ�ζ��յ�ʱ����ɫ����ɫ��Ϊ�Ϻ�ɫ���Ұ�����ڲ���ɫ��
�ʴ�Ϊ����ֹKMnO4����ֽ⣻��ƿ�е���Һ��ɫ����ɫ��Ϊ�Ϻ�ɫ���Ұ�����ڲ���ɫ��
����CN-���ʵ���Ϊn�������ݷ���ʽ��֪��
2MnO4-+8H++2CN-=2Mn2++2CO2+N2+4H2O
2 2
0.020 0mol/L��0.025L n
���n=0.0005mol��
�ʴ�Ϊ��0.000 5��
�����ζ�����ʢ�ű���Һǰδ�ñ�Һ��ϴ�����¸�����ر�Һ��ϡ�ͣ����ĵı�Һƫ�࣬����C��=$\frac{C��V��}{V��}$��֪�ⶨ�����ƫ�ߣ�
�ʴ�Ϊ��ƫ�ߣ�
���� �����Զ������ȵ��Ʊ������ʼ���Ϊ���忼����������ԭ��Ӧ����ʽ����д��������ԭ�ζ����������ʵ�Ũ�ȣ���Ϥ�Ʊ�ԭ����ȷ���������Ϣ�ǽ���ؼ�����Ŀ�ѶȽϴ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����0.1mol/L CuSO4��Һ100 mL�������CuSO4•5H2O 1.6g | |
| B�� | 40g NaOH��������1 Lˮ��������Һ��Ũ��Ϊ1 mol/L | |
| C�� | 200mL 0.2mol/L MgCl2��Һ��Cl-�ĸ���Ϊ0.08NA | |
| D�� | ��100mL 1mol/L H2SO4��Һȡ��10mL��Һ������Һ��Ũ��Ϊ0.1 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ʣ�������ͭ | |
| B�� | ԭ����������ͭ��������9.6g | |
| C�� | ��Ӧ����Һ��n��Fe3+��=0.10mol | |
| D�� | ��Ӧ����Һ��n��Fe2+��+n��Cu2+��=0.75mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Al��Mg��Na | B�� | Mg��Al��Na | C�� | Na��Mg��Al | D�� | Na��Al��Mg |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������ϡ���ᷴӦ��FeO+2H+�TFe3++H2O | |
| B�� | ��NaͶ�뵽CuSO4��Һ��2Na+Cu2+�T2Na++Cu | |
| C�� | ������ˮ��Ӧ��Cl2+H2O�T2H++Cl-+ClO- | |
| D�� | SiO2��NaOH��Һ��Ӧ��SiO2+2OH-�TSiO32-+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
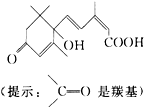
| A�� | ����̼̼˫�����ǻ����ʻ����Ȼ� | B�� | ���б������ǻ����ʻ����Ȼ� | ||
| C�� | �����ǻ����ʻ����Ȼ������� | D�� | ����̼̼˫�����������ǻ����ʻ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
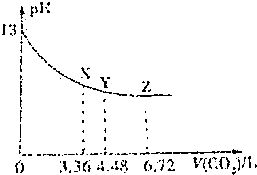
| A�� | ��NaOH��Һ��Ũ��Ϊ0.1mol/L�����Ϊ6L | |
| B�� | X��Y��Z�����Ӧ����Һ�����ӵ����ͬ | |
| C�� | Y���Ӧ������������Ũ�ȹ�ϵΪ��c��Na+����c��HCO3-����c��CO32-����c��OH-����c��H+�� | |
| D�� | Y���Ӧ����Һ�д����ţ�c��Na+��=2c��HCO3-��+c��OH-�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com