(1)用CaSO
4代替O
2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO
2,是一种高效、清洁、经济的新型燃烧技术.反应①为主反应,反应②和③为副反应.
①
CaSO
4(s)+CO(g)?
CaS(s)+CO
2(g)△H
1②CaSO
4(s)+CO(g)?CaO(s)+CO
2(g)+SO
2(g)△H
2③CO(g)?
C(s)+
CO
2(g)△H
3则反应2CaSO
4(s)+7CO(g)?CaS(s)+CaO(s)+6CO
2(g)+C(s)+SO
2(g)的△H=
(用△H
1、△H
2和△H
3表示)
(2)将燃煤废气中的CO
2转化为二甲醚的反应原理为:2CO
2(g)+6H
2(g)
CH
3OCH
3(g)+3H
2O(g);△H
①该反应平衡常数表达式为K=
.
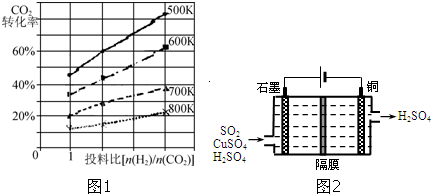
②已知在某压强下,该反应在不同温度、不同投料比时,CO
2的转化率如图1.该反应的△H
(填“>”“<”或“=”)0.若温度不变,减小反应投料比[n(H
2)/n(CO
2)],则K将
(填“增大”“减小”或“不变”).
③二甲醚燃料电池具有启动快,效率高等优点,若电解质为酸性,二甲醚燃料电池的负极反应为
.
(3)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO
2的部分催化氧化,所发生反应为:2SO
2+2nCu+(n+1)O
2+(2-2n)H
2O=2nCuSO
4+(2-2n)H
2SO
4 从环境保护的角度看,催化脱硫的意义为
.
②利用图2电化学装置吸收另一部分SO
2,并完成Cu的再生.写出装置内所发生反应的总的离子方程式:
.




 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案 维生素A对人体,特别是对人的视力有重大作用,其结构简式如图所示:
维生素A对人体,特别是对人的视力有重大作用,其结构简式如图所示: