
【题目】氮元素能够形成多种化合物。请回答下列问题:
(1)联氨(N2H4)常温下为液态,在空气中迅速完全燃烧生成N2,同时放出大量热,可作导弹、宇宙飞船、火箭的燃料。
已知:H2(g)+1/2O2(g)==H2O(l);△H1=-285.8kJ/mol
N2(g)+2H2(g)=N2H4(l);△H2=+50.6kJ/mol
则N2H4(l)在空气燃烧生成液态水的热化学方程式为_____________。
(2)工业上利用氨气生产氢氰酸(HCN)的反应为CH4(g)+NH3(g)![]() HCN(g)+3H2(g) △H>0。
HCN(g)+3H2(g) △H>0。
①一定温度下,向2L恒容容器中充入1mol CH4(g)和2mol NH3(g)发生上述反应,4min达到平衡时,测得CH4的转化率为66.67%。0~4min內,用H2表示的该反应速率v(H2)=_____。
保持温度和容积不变,再句平衡后的容器中充入2molNH3和2molH2,此时v正___v逆(选填“>”“<”或“=”)。
②平衡体系中HCN的物质的量(n)随某物理量变化曲线如图所示(图中x、L分别表示温度或压强)。
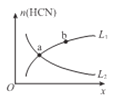
若x为温度,则曲线,____(选填“L1”或“L2”)能正确表示n (HCN) 与温度的关系;
若x为压强,则曲线____(选填“L1”或“L2”)能正确表示n HCN)与压强的关系。
(3)NH3能够形成Ag(NH3)2+。
①溶液中存在Ag+ (aq)+2NH3 (aq)==Ag( NH3)2+(aq )时,其平衡常数的表达式为K稳=_______。
②常温下,K稳[Ag(NH3)2+]=1.10×107,反应AgCl (s)+2NH3 (aq)![]() Ag( NH3)2+(aq) +Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=_____。
Ag( NH3)2+(aq) +Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=_____。
(4)硫氧化物和氮氧化物是常见的大气污染物,利用如图所示发置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。
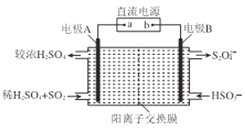
①电极A的电极反应式为______________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体。同时有SO32-生成。该反应离子方程式为______________。
【答案】 N2H4(l)+O2(g)=N2(g)+2H2O(l) △H=-622.2kJ/mol 0.25mol/(L·min) < L1 L2 ![]() 1.76×10-10 SO2+2H2O-2e-=SO42-+4H+ 4S2O42-+2NO2+8OH-=8SO32-+N2+4H2O
1.76×10-10 SO2+2H2O-2e-=SO42-+4H+ 4S2O42-+2NO2+8OH-=8SO32-+N2+4H2O
【解析】(1). 已知: ① H2(g)+1/2O2(g)==H2O(l) △H1=-285.8kJ/mol,② N2(g)+2H2(g)=N2H4(l) △H2=+50.6kJ/mol,根据盖斯定律,①×2—②得:N2H4(l)+O2(g)=N2(g)+2H2O(l) △H=-622.2kJ/mol,故答案为:N2H4(l)+O2(g)=N2(g)+2H2O(l) △H=-622.2kJ/mol;
(2). ①. 4min达到平衡时,消耗CH4的物质的量为n(CH4)=1mol×66.67%,由反应方程式可知,生成H2的物质的量为n(H2)=3n(CH4)= 1mol×66.67%×3=2mol,则0~4min內,用H2表示的该反应速率v(H2)=2mol÷2L÷4min=0.25mol/(L·min),根据反应方程式及上述计算结果可知,达到平衡时c(CH4)=![]() mol/L、c(NH3)=
mol/L、c(NH3)=![]() mol/L、c(HCN)=
mol/L、c(HCN)=![]() mol/L、c(H2)=1mol/L,则平衡常数K=
mol/L、c(H2)=1mol/L,则平衡常数K=![]() =3,再向平衡后的容器中充入2mo NH3和2molH2,Qc=
=3,再向平衡后的容器中充入2mo NH3和2molH2,Qc=![]() =9.6>K=3,说明v正<v逆,平衡逆向移动,故答案为:0.25mol/(L·min);<;
=9.6>K=3,说明v正<v逆,平衡逆向移动,故答案为:0.25mol/(L·min);<;
② . 该反应为吸热反应,升高温度平衡正向移动,HCN的物质的量增大,则L1能正确表示n(HCN)与温度的关系;该反应为气体分子总数增大的反应,增大压强平衡逆向移动,HCN的物质的量减小,则L2能正确表示n(HCN)与压强的关系,故答案为:L1;L2;
(3). ①. 平衡常数等于生成物平衡浓度的幂之积除以反应物浓度的幂之积,则平衡常数的表达式为:K稳= ![]() ,故答案为:
,故答案为:![]() ;
;
②. Ksp(AgCl)=c(Ag+)×c(Cl-)=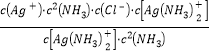 =
=![]() =
=![]() =1.76×10-10,故答案为:1.76×10-10;
=1.76×10-10,故答案为:1.76×10-10;
(4). ①. 由装置图中信息可知电极A为阳极,电极反应式为:SO2+2H2O-2e-=SO42-+4H+,故答案为:SO2+2H2O-2e-=SO42-+4H+;
②. 阴极排出的溶液中含有S2O42-,被NO2氧化为SO32-,根据得失电子守恒和原子守恒,该反应的离子方程式为:4S2O42-+2NO2+8OH-=8SO32-+N2+4H2O,故答案为:4S2O


科目:高中化学 来源: 题型:
【题目】NaClO2是一种漂白、消毒剂,广泛应用于纸浆、棉纺等物质漂白。一种制备NaClO2粗产品的工艺流程如下图所示:
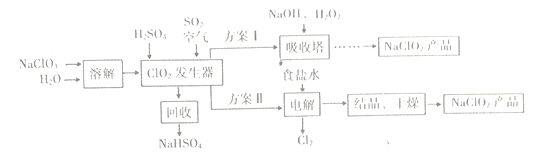
已知:①纯净的ClO2因易分解而发生爆炸。
②NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O晶体;高于38℃时析出
NaClO2晶体;高于60℃时NaClO2分解生成NaClO3和NaCl。
试回答下列问题:
(1)向发生器中鼓入足量空气,其目的是____(选填序号)。
a.将SO2氧化成SO3,以增强酸性
b.稀释CO2气体,以防止发生爆炸
c.将发生器中气体全部吹出,以减少ClO2损失
(2)吸收塔中反应的离子方程式为___
(3)ClO2发生器中反应的化学方程式为___________
(4)从吸收塔中可获得 NaClO2溶液,从NaClO2溶液到NaCO2产品,经过的操作步骤依次为:①______℃下减压蒸发结晶;②________;③洗涤;④低温干燥,得到成品。
(5)“电解”中阳极的电极反应式是_________,阴极反应的主要产物是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 需要加热才能发生的反应一定是吸热反应
B. 浓硫酸溶于水是放热反应
C. 反应物和生成物所具有的总能量决定了放热还是吸热
D. 断开化学键放热,形成化学键吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图如右。下列说法不正确的是

A. 该过程将太阳能转化成为化学能
B. 该过程中,只涉及极性键的断裂与生成
C. 氧化剂与还原剂的物质的量之比为1∶3
D. 原料气N2可通过分离液态空气获得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
反应I:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=―905.0 kJ·molˉ1
反应 II:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H
2N2(g) +6H2O(g) △H
(1)
化学键 | H—O | O=O | N≡N | N—H |
键能kJ·molˉ1 | 463 | 496 | 942 | 391 |
△H=__________________ 。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是__________________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:
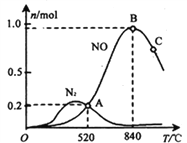
①该催化剂在高温时选择反应____________ (填“ I ”或“ II”)。
② 520℃时,4NH3(g)+5O2![]() 4NO(g) +6H2O(g)的平衡常数K=____________________________ (不要求得出计算结果,只需列出数字计算式)。
4NO(g) +6H2O(g)的平衡常数K=____________________________ (不要求得出计算结果,只需列出数字计算式)。
③有利于提高NH3转化为N2平衡转化率的措施有_______________
A.使用催化剂Pt/Ru
B.使用催化剂Cu/TiO2
C.增大NH3和O2的初始投料比
D.投料比不变,增加反应物的浓度
E.降低反应温度
(4)采用氨水吸收烟气中的SO2,
①若氨水与SO2恰好完全反应生成正盐,则此时溶液呈_____性(填“酸”或“碱”)常温下弱电解质的电离平衡常数如下:氨水:Kb=1.8×10ˉ5mol·Lˉ1;H2SO3 :Ka1=1.3×10ˉ2mol·Lˉ1,Ka2=6.3×10ˉ8mol·Lˉ1
②上述溶液中通入______气体可使溶液呈中性,(填“SO2”或NH3”)此时溶液离子浓度由大到小的顺序_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(1)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:

已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________步反应决定,总反应进行到_________min时到达平衡。
(3)电解尿素[CO(NH2)2]的碱性溶液制纯净氢气的过程中同时产生氮气。电解时,阳极的电极反应式为________________________________。
Ⅱ.用焦炭还原NO2的反应为:2NO2(g)+2C(s )![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
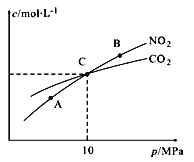
①A、B两点的浓度平衡常数关系:Kc(A)_______Kc(B) (填 “﹥”、“<”或“﹦”)。
②计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取一定量的PbI2固体配成饱和溶液,t时刻改变某一条件,离子浓度变化如右图所示。下列有关说法正确的是

A. 常温下,PbI2的Ksp为2×10-6
B. 常温下,Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,反应PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)的化学平衡常数为5×1018
PbS(s)+2I-(aq)的化学平衡常数为5×1018
C. 温度不变,t时刻改变的条件可能是向溶液中加入了KI固体,PbI2的Ksp增大
D. 温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,平衡向左移动,Pb2+的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的溶液时,由于操作不慎,使液面略超过了容量瓶的刻度(标线),这时应采取的措施是( )
A.倾出标线以上的液体
B.吸出标线以上的溶液
C.影响不大,不再处理
D.重新配制
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com