
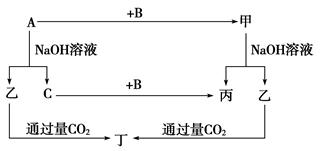


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源:不详 题型:计算题
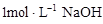
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.因为铝对人体有害,故不能使用铝锅等炊具。 |
| B.一种治疗胃酸过多的药物的主要成分是Al(OH)3,因此铝元素超标对人体无影响。 |
| C.膨化食品中的铝元素超标可能来自发酵剂明矾。 |
| D.土壤的主要成分是Al2O3·2SiO2·2H2O,因此粮食中含有较多的铝元素,人过多食用铝元素的食品显然也没有影响。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝是一种比较活泼的金属 |
| B.在常温下,铝不能与氧气反应 |
| C.在化学反应中铝容易得电子,是氧化剂 |
| D.宜用铝制餐具蒸煮酸性、碱性或咸的食物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.67.2L | B.22.4L | C.16.8L | D.44.8L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
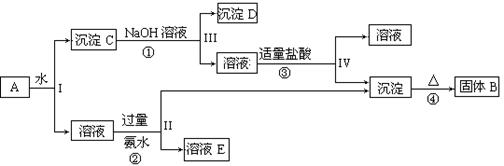
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 测定生成气体的体积
测定生成气体的体积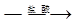 测定生成气体的体积
测定生成气体的体积 溶液
溶液
 称量灼烧产物的质量。
称量灼烧产物的质量。
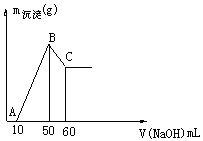
 溶液时,生成沉淀的质量与加入
溶液时,生成沉淀的质量与加入 溶液体积的关系可用数轴关系表示:
溶液体积的关系可用数轴关系表示: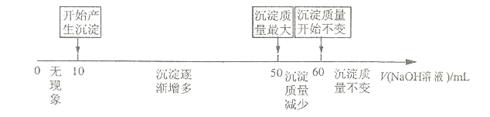
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com