

分析 该实验探究NH3催化氧化反应,在催化剂条件下,氨气和氧气在E处发生氧化还原反应生成NO和水蒸气,所以A中生成的气体中含有氨气和氧气,加热碳酸氢铵时,发生反应NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO2↑+NH3↑,碳酸氢铵分解生成的气体中不含氧气,H2O、CO2和Na2O2反应生成O2,且除去杂质H2O、CO2,所以X为Na2O2,生成的NO是无色气体,NO不稳定易被氧化生成红棕色气体NO2,二氧化氮和水反应生成硝酸,硝酸和Cu反应生成硝酸铜、NO和水,氮氧化物有毒,不能直接排空,要连接尾气处理装置;
(1)装置A试管中的化合物X是Na2O2;
(2)实验进行一段时间后,观察到装置G中溶液变成蓝色,说明Cu发生氧化还原反应生成铜离子,二氧化氮和水反应生成的硝酸与铜发生氧化还原反应生成硝酸铜;
(3)甲、乙两同学分别按上述装置进行实验,一段时间后,甲观察到装置F中有红棕色气体说明有二氧化氮生成,乙则观察到装置F中只有白烟生成,二氧化氮和水反应生成硝酸,硝酸和氨气反应生成硝酸铵固体;
(4)为了帮助乙实现在装置F中也观察到红棕色气体生成,可在原实验基础上进行改进.
①甲认为是E反应后剩余O2太少导致F中无红棕色气体产生,预先在装置A试管内,除了NH4HCO3和X外,适当加入钠盐,该钠盐能受热分解生成二氧化碳、水;
②乙则认为,可以在装置E、F之间增加一个装置,该装置要除去水蒸气.
解答 解:该实验探究NH3催化氧化反应,在催化剂条件下,氨气和氧气在E处发生氧化还原反应生成NO和水蒸气,所以A中生成的气体中含有氨气和氧气,加热碳酸氢铵时,发生反应NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO2↑+NH3↑,碳酸氢铵分解生成的气体中不含氧气,H2O、CO2和Na2O2反应生成O2,且除去杂质H2O、CO2,所以X为Na2O2,生成的NO是无色气体,NO不稳定易被氧化生成红棕色气体NO2,二氧化氮和水反应生成硝酸,硝酸和Cu反应生成硝酸铜、NO和水,氮氧化物有毒,不能直接排空,要连接尾气处理装置;
(1)装置A试管中的化合物X是Na2O2,故答案为:Na2O2;
(2)实验进行一段时间后,观察到装置G中溶液变成蓝色,说明Cu发生氧化还原反应生成铜离子,NO和氧气反应生成NO2,NO2和水反应生成的HNO3与Cu发生氧化还原反应生成硝酸铜、NO和水,铜离子呈蓝色,发生的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(3)甲、乙两同学分别按上述装置进行实验,一段时间后,甲观察到装置F中有红棕色气体说明有二氧化氮生成,乙则观察到装置F中只有白烟生成,E中生成NO和水,生成的NO被氧气氧化生成红棕色气体NO2,NO2和水反应生成HNO3,HNO3和氨气反应生成NH4NO3固体,所以白色固体成分是NH4NO3,故答案为:NH4NO3;
(4)为了帮助乙实现在装置F中也观察到红棕色气体生成,可在原实验基础上进行改进.
①甲认为是E反应后剩余O2太少导致F中无红棕色气体产生,预先在装置A试管内,除了NH4HCO3和X外,适当加入钠盐,该钠盐能受热分解生成二氧化碳、水,所以可以是NaHCO3,故答案为:NaHCO3;
②乙则认为,可以在装置E、F之间增加一个装置,该装置要除去水蒸气,a、b、c都可以吸收水蒸气且和NO不反应,故选abc.
点评 本题考查性质实验方案设计,为高考高频点,明确实验原理及物质性质是解本题关键,熟悉流程图中各个装置的作用,同时考查学生实验操作及实验分析能力,知道各个装置发生的反应,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 分子式 | 限定条件 | 数目 |
| A | C2H4O2 | 能与Na2CO3溶液反应 | 2 |
| B | C4H8Cl2 | 分子中有一个甲基 | 3 |
| C | C4H10O | 不能与钠反应 | 2 |
| D | C8H10 | 含有苯环 | 3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 | V(0.5mol•L-1 HCl)/mL | m(CaCO3)/g | CaCO3状态 | V(蒸馏水)/mL | 实验目的 | |
| 实验1 | 40.0 | 0.8 | ①实验1和2探究固体表面积对反应速率的影响; ②实验1和3探究反应物浓度对反应速率的影响 | |||
| 实验2 | 40.0 | 0.8 | ||||
| 实验3 | 60.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
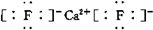 ;若XY2为共价化合物时,其结构式为:S=C=S.
;若XY2为共价化合物时,其结构式为:S=C=S.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

 ②H2S
②H2S 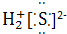
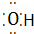 ④Al3+ Al3+ ⑤N2 N$\underset{\stackrel{•}{•}}{•}$ $\underset{\stackrel{•}{•}}{•}$N
④Al3+ Al3+ ⑤N2 N$\underset{\stackrel{•}{•}}{•}$ $\underset{\stackrel{•}{•}}{•}$N ⑦HClO
⑦HClO 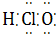 ⑧Na2O2
⑧Na2O2 
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ②③⑤⑥⑦ | D. | ①④⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com