
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):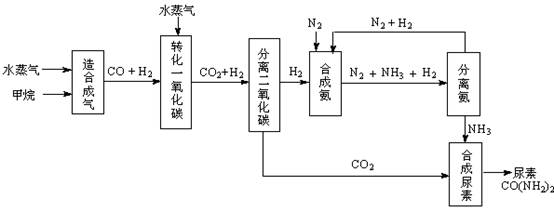
(1)“造合成气”发生的热化学方程式是CH4(g)+H2O(g) 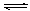 CO(g)+3H2(g);△H>0
CO(g)+3H2(g);△H>0
在恒温恒容的条件下,欲提高CH4的反应速率和转化率,下列措施可行的是 。
A、增大压强 B、升高温度 C、充入He气 D、增大水蒸气浓度
(2)“转化一氧化碳”发生的方程式是H2O(g) +CO(g) 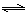 H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(1)B D (选对1个得1分,只要选错得0分)
(2)不变;> (3)A
(4)2:1;有利于提高CO2的转化率,因为NH3极易溶于水,便于分离、回收利用
(5)4.8×108
解析试题分析:(1)A、增大压强,反应速率加快,平衡向逆反应方向移动,甲烷的转化率降低,故A错误;
B、升高温度,反应速率加快,平衡向正反应方向移动,甲烷的转化率增大,故B正确;
C、充入He气,反应混合物的浓度不变,反应速率不变,平衡不移动,甲烷的转化率不变,故C错误;
D、增大水蒸气浓度,反应速率加快,平衡向逆反应方向移动,甲烷的转化率增大,故D正确;
故答案为:BD;
(2)平衡常数只受温度影响,与反应物的浓度无关,提高氢碳比(2)平衡常数只受温度影响,与反应物的浓度无关,提高氢碳比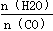 ,K值不变;
,K值不变;
令开始H2O和CO的物质的量都是1mol,某一时刻时CO和CO2的浓度比为1:3,设此时参加反应CO为xmol,则(1-x):x=1:3,解得x=0.75,则:
H2O(g)+CO(g) H2(g)+CO2(g),
H2(g)+CO2(g),
开始(mol):1 1 0 0
变化(mol):0.75 0.75 0.75 0.75
某时刻(mol):0.25 0.25 0.75 0.75
故产生浓度商Qc=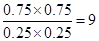 <9.94,反应向正反应进行,故v(正)>v(逆),
<9.94,反应向正反应进行,故v(正)>v(逆),
故答案为:不变;>;
(3)A.固氮指由游离态的氮转化为化合态的氮,合成氨属于人工固氮,故A正确;
B.催化剂加快反应速率,不能影响平衡移动,不能提高反应物的利用率,故B错误;
C.该反应正反应是放热反应,高温不利用氨气的合成,合成氨反应温度控制在500℃左右,在该温度下反应速率较快、催化剂活性较高,故C错误;
D.合成氨工业采用循环操作,目的是提高原料的利用率,故D错误;
故答案为:A;
(4)根据尿素的化学式CO(NH2)2,C、N原子完全利用最后,由C、N原子守恒可知生产尿素过程中,理论上n(NH3):n(CO2)的最佳配比为2:1;
往往使n(NH3):n(CO2)≥3,这是由于:有利于提高CO2的转化率,且NH3极易溶于水,便于分离、回收利用;
故答案为:2:1;有利于提高CO2的转化率,且NH3极易溶于水,便于分离、回收利用;
(5)由CH4(g)+H2O(g) CO(g)+3H2(g),N2(g)+3H2(g)
CO(g)+3H2(g),N2(g)+3H2(g) 2NH3(g),可得CH4(g)~3H2(g)~2NH3(g),设能够合成氨气的体积为VL,则:
2NH3(g),可得CH4(g)~3H2(g)~2NH3(g),设能够合成氨气的体积为VL,则:
CH4(g)~3H2(g)~2NH3(g),
1 2
3.0×108L×60% VL
故V=3.0×108L×60%×2=3.6×108L
合成气的反应中:CH4 ~ CO ~ 3H2,
3.0×108L×60% 3.0×108L×60% 3.0×108L×60%×3
分离二氧化碳过程生成的H2体积:CO ~ H2,
3.0×108L×60% 3.0×108L×60%
所以产生的氢气的总体积为3.0×108L×60%×3+3.0×108L×60%=12×108L×60%
令产生氨气的体积为V,则:
3H2 ~ 2NH3
3 2
12×108L×60% V
故V=12×108L×60%×2/3
=4.8×108L
故答案为:4.8×108.
考点:化学平衡的影响因素;化学平衡的调控作用


科目:高中化学 来源: 题型:填空题
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO ( g ) + 2H2 ( g )  CH3OH ( g ) △H=-116kJ/mol
CH3OH ( g ) △H=-116kJ/mol
(1)该反应的化学平衡常数表达式为 ;
(2)下列措施中有利于增大该反应的反应速率且提高转化率的是 (填字母序号) 。
a.随时将CH3OH与反应混合物分离 b.降低反应温度
c.使用高效催化剂 d.增大体系压强
(3)一定条件下,将1 mol CO与3 mol H2的混合气体在催化剂作用下发生反应生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号).
a.c ( H2 )减少 b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加 d.重新平衡c ( H2 )/ c (CH3OH )减小
(4) 在密闭容器中充有1mol CO与2 mol H2,在催化剂作用下反应生成甲醇,CO的转化率(α)与温度(T)、压强(P)的关系如图所示。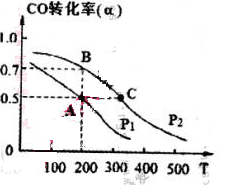
①A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间,tA tC(填“大于”、“小于’’或“等于")。
②若A点时容器的体积为1 L,该温度下B点的平衡常数 K= 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)已知:T℃、P kpa时,容积为V 的密闭容器中充有1molA和2molB,保持恒温恒压使反应达平衡:A(g)+B(g) C(g),平衡时C 的体积分数为40℅。
C(g),平衡时C 的体积分数为40℅。
(1)欲保持温度、压强在上述条件下不变,在密闭容器中充入2molA和4molB,则平衡时体系容积为 ,C的体积分数为 。
(2)另取一个容积固定不变的密闭容器,仍控制温度为T℃,加入1molB和1molC,要使平衡时C 的体积分数仍为40℅,则该密闭容器体积为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。已知:
CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 H2(g)+CO2(g),当反应达平衡时,CO的体积分数为X,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数不等于X的有
H2(g)+CO2(g),当反应达平衡时,CO的体积分数为X,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数不等于X的有 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一定体积的密闭容器中,进行如下反应:A(g) B(g)+C(g),其化学平衡常数K和温度t的关系如下表所示:
| toC | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |

| 时间t/min | 0 | 1 | 2 | 4 | 8 | 16 | 20 |
| C(A)/(mol·L-1) | 10.4 | 8.6 | 7.5 | 6.6 | 5.9 | 5.5 | 5.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示.
(已知:2SO2 (g)+O2(g) 2SO3(g) △H=-196.6 KJ·mol-1)
2SO3(g) △H=-196.6 KJ·mol-1)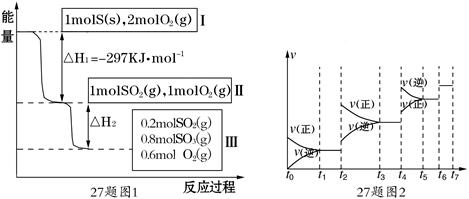
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式: .
(2)ΔH2 =
(3)恒温恒容时,1molSO2和2molO 2充分反应,放出热量的数值比∣ΔH2 ∣ (填“大”、“小”或 “相等”)
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为 ,若溶液中发生了氧化还原反应,则该过程的离子方程式为 .
(5)恒容条件下,下列措施中能使n(SO3)/ n(SO2 )增大的有 .
a.升高温度;
b.充入He气
c.再充入1molSO2 (g)和1molO 2 (g)
d.使用催化剂
(6)某SO2 (g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率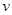 与时间t的关系如图2所示,若不改变SO2 (g)和O2 (g)的量,则图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 .
与时间t的关系如图2所示,若不改变SO2 (g)和O2 (g)的量,则图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 .
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡常数表达式为: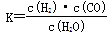 ,它所对应反应的化学方程式是
,它所对应反应的化学方程式是
_________________________________。
(2)合成甲醇的主要反应是:2H2(g)+CO(g) CH3OH(g)+90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
CH3OH(g)+90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度(mol/L) | 0.2 | 0.1 | 0.4 |
| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钢铁是21世纪用途最广的结构材料和功能材料。其成分主要是Fe和少量C。
(1)工业上在炼铁高炉中用CO热还原Fe2O3冶炼铁。写出该反应的化学方程式并用单线桥表示电子转移的方向和数目 。
(2)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图(黑球代表Fe,白球代表Mg)。则铁镁合金的化学式为 。
(3)Fe3+的电子排布式为 ;CH3+微粒的中心原子杂化轨道类型为 ;
(4)向一定量的FeCl3溶液中加入适量KSCN溶液,溶液变红色。该反应体系中存在化学平衡 (用反应式表示);向上述红色溶液中加入Mg(OH)2固体,可观察到溶液红色变浅,有红褐色沉淀析出。试用平衡移动原理解释该现象 。(不考虑SCN—与Mg2+反应)
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
工业上可以利用废气中的CO2为原料制取甲醇,其反应方程式为:CO2+3H2 CH3OH+H2O。请回答下列问题:
CH3OH+H2O。请回答下列问题:
(1)已知常温常压下下列反应的能量变化如下图所示:
|
|
|
|

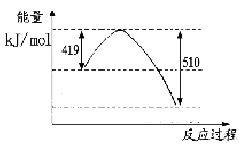 写出由二氧化碳和氢气制备甲醇的热化学方程式__ _。
写出由二氧化碳和氢气制备甲醇的热化学方程式__ _。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com