
【题目】下列物质性质与应用对应关系不正确的是
A. 乙烯可以发生加成反应,常用作制取溴乙烷
B. 三硝基甲苯(TNT)难溶于水,可用作烈性炸药
C. 丙三醇具有很强的吸湿性,可用作配制化妆品
D. 乙炔可燃(氧炔焰温度可达3000℃以上),氧炔焰常用作焊接金属
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】现有三组溶液.①汽油和氯化钠溶液;②乙醇和四氯化碳溶液的混合物;③氯化钠和单质碘的水溶液。分离以上混合物的正确方法依次是( )
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对合金的说法正确的是( )
A.合金中至少含有两种金属元素,可能不含非金属元素
B.合金中的金属元素以化合物的形式存在
C.一些合金具有固定配比,所以合金是纯净物
D.合金的硬度可以大于成分金属.而熔点可以低于成分金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
SO3(g)+NO(g)+Q(Q>0)可处理NO2、SO2等大气污染物,具有十分重要的意义。
完成下列填空:
(1)该反应中被氧化的元素是__________;写出该反应的平衡常数表达式:K =_____________。
(2)若上述反应在一密闭容器中进行。下列能表明反应达到平衡状态的是_______(选填编号)。
a.混合气体颜色保持不变
b.NO2和NO的体积比保持不变
c.每消耗1mol SO2的同时生成1mol SO3
d.体系中气体密度保持不变
(3)一定温度下,在容积为V L的容器中发生上述反应,t min内,SO2的物质的量下降了a mol,则这段时间内v(NO) =__________(用相关字母表示并注明单位)。
(4)请写出两种能提高SO2转化率的措施:_____________、_____________。
(5)亚硫酸溶液久置,pH会变小,请用方程式表示其原因_______________
(6)将SO2持续通入NaOH溶液中,溶液中SO32—的浓度变化如图所示,请解释原因。
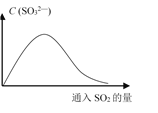
__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一重要烃的衍生物,其结构简式如图所示,下列说法中正确的是
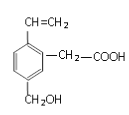
A. 该物质的分子式为C11H13O3
B. 该物质可以使酸性高锰酸钾溶液褪色,证明其含有碳碳双键
C. 1mol该有机物,一定条件下最多可以和5molH2加成
D. 1mol该有机物,与Na和NaHCO3反应产生的气体在相同条件下体积比为1 :1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中的杂质并且不引入新的杂质,所用试剂和方法正确的是( )
选项 | 物质 | 杂质 | 除杂质所用试剂和方法 |
A | CO | CO2 | 通入灼热的CuO |
B | KNO3 | K2SO4 | BaCl2溶液,过滤 |
C | Cu | CuO | 稀硫酸,过滤 |
D | CaCO3 | CaO | 盐酸,过滤 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯可生产多种化工原料,根据如图所示的转化关系回答问题: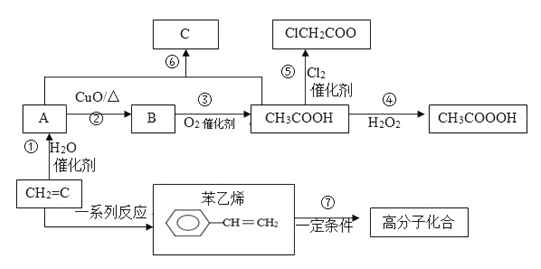
(1)写出下列物质的结构简式:A______;B______;C_______。
(2)反应①~⑦中,属于取代反应的是________(填序号)。
(3)反应②的化学方程式为______________,反应⑦的化学方程式为_________________
(4)苯乙烯是一种重要的化工原料,下列说法正确的___________________
a.该分子中所有原子可能在同一平面上
b.它与足量的H2加成后得到的产物的一溴代物有5种
c.该物质能发生氧化反应和加成反应
(5)重要化工原料氯乙酸(CH2Cl-COOH)与水反应可得到羟基乙酸(HOCH2-COOH),羟基乙酸与反应⑤的产物过氧乙酸互为________(选填“同系物”、“同分异构体”、“同素异形体”或“同位素”);羟基乙酸与乳酸[CH3CH(OH)COOH]的混合物,在浓硫酸作用下脱去一分子水可得到_________种链酯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R、Q、W均为短周期主族元素,部分信息如下表所示:
X | Y | Z | M | R | Q | W | |
原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | 0.077 | ||
主要化合价 | -4,+4 | -2 | -1,+7 | +3 | -4,+4 | ||
其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)Y在元素周期表中的位置是_____。
(2)写出化合物XRM的电子式:_____;比较Z、M、R三种元素对应的简单离子半径大小_____。(用离子符号和“>”表示)
(3)Z与Q相比,金属性较强的是_____(用元素符号表示),下列事实能证明这一结论的是
_____(选填字母序号)。
a.Z的熔点低于Q
b.常温下,Z与水剧烈反应而Q不能
c.最高价氧化物对应的水化物碱性:ZOH > Q(OH)3
d.最外层电子数:Q > Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com