
打破“生命力论”的科学家是( )
A.道尔顿 B.贝采利乌斯
C.维勒 D.爱因斯坦
科目:高中化学 来源: 题型:
燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。完成下列关于甲烷(CH4)燃料电池的填空:
(1)甲烷与氧气反应的化学方程式为:__________________。
(2)已知燃料电池的总反应式为CH4+2O2+2KOH===K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-===CO+7H2O,这个电极是燃料电池的________(填“正极”或“负极”),另一个电极上的电极反应式为:___________________________。
(3)随着电池不断放电,电解质溶液的碱性________(填“增大”“减小”或“不变”)。
(4)通常情况下,甲烷燃料电池的能量利用率______(填“大于”“小于”或“等于”)甲烷燃烧的能量利用率。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述或表示方法正确的是( )
A.伴有能量变化的物质变化都是化学变化
B.0.5 mol H2完全燃烧生成水蒸气放出热量121 kJ,H2燃烧的热化学方程式表示为:2H2(g)+O2(g)===2H2O(g) ΔH=-242 kJ·mol-1
C.由C(金刚石)===C(石墨) ΔH=-1.90 kJ·mol-1,可知石墨比金刚石稳定
D.一个化学反应中,当生成物能量大于反应物能量时,反应放热,ΔH为“-”
查看答案和解析>>
科目:高中化学 来源: 题型:
利用金属A(活泼性比氢强)和石墨棒B构成原电池,电解质溶液为稀硫酸,关于此装置的下列说法中正确的是( )
A.A为正极,B为负极
B.导线上有电流通过,电流的方向从A→B
C.反应后,A极质量减小
D.B极上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示。
(1)在银圈和铁圈(用细塑料棒连接)的连接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液。片刻后可观察到的现象是___________________________________。

(2)将(1)中细塑料棒取下,使银圈和铁圈接触,连接处吊着一个绝缘的细丝,调整圈的大小,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液。片刻后可观察到的现象是____________________,其原因是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用元素分析仪分析12.0 mg某有机物,测得生成17.6 mg CO2和7.2 mg H2O,无其他物质生成,下列说法中正确的是( )
A.该有机物的分子式为C2H6O2
B.该有机物中碳、氢原子个数比为1:1
C.无法确定该有机物中是否含有氧元素
D.该有机物中一定含有氧元素
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物在O2中充分燃烧,生成36 g水和44 g CO2,则该有机物的组成必须满足的条件是( )
A.分子式一定是CH4
B.分子式一定是CH4O
C.分子式可能是CH4或CH4O
D.以上说法均不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
下列氧化反应属于吸热反应的是( )
A.工业上制氨气的反应 B.葡萄糖在人体内氧化分解
C.锌粒与稀H2SO4反应制取H2 D.Ba(OH)2·8H2O与NH4Cl反应
查看答案和解析>>
科目:高中化学 来源: 题型:
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1) COCl2的空间构型为 ;溴的价电子排布式为 。
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列
式发生。
A. CsICl2=CsCl+ICl B. CsICl2=CsI+Cl2
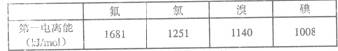
(3)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是 。
(4)下列分子既不存在s-p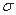 键,也不存在p-p
键,也不存在p-p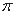 键的是 。
键的是 。
A. HCl B.HF C. SO2 D. SCl2
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为 ,写出CN-的等电子体的分子式 (写出1个)。
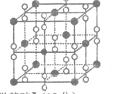
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图所示:由此可判断该钙的氧化物的化学式为 。已知该氧化物的密度是 g·cm-3,则晶胞离得最近的两个钙离子间的距离为_ cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
g·cm-3,则晶胞离得最近的两个钙离子间的距离为_ cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com