
 ;V原子的结构示意图
;V原子的结构示意图 ;Z的氢化物结构式为
;Z的氢化物结构式为 ;写出U元素在周期表中的位置第三周期VIA族;N2W2中含有的化学键有离子键、共价键(化学键类型)
;写出U元素在周期表中的位置第三周期VIA族;N2W2中含有的化学键有离子键、共价键(化学键类型)分析 X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大.Y原子的L层电子数是K层电子数的2倍,则L层电子数为4,故Y为C元素;Z、W的单质常温下均为无色气体,结合原子序数可知Z为N元素、W为O元素;X与N同主族,且与W都能形成A2B、A2B2型化合物,则X为H元素、N为Na元素;U、V处于第三周期,U原子的最外层电子数是其电子层数的2倍,最外层电子数为6,故U为S元素,则V为Cl,据此解答.
解答 解:X、Y、Z、W、N、U、V是短周期的主族元素,原子序数依次增大.Y原子的L层电子数是K层电子数的2倍,则L层电子数为4,故Y为C元素;Z、W的单质常温下均为无色气体,结合原子序数可知Z为N元素、W为O元素;X与N同主族,且与W都能形成A2B、A2B2型化合物,则X为H元素、N为Na元素;U、V处于第三周期,U原子的最外层电子数是其电子层数的2倍,最外层电子数为6,故U为S元素,则V为Cl.
(1)YW2为CO2,电子式为 ;V为Cl元素,原子的结构示意图为
;V为Cl元素,原子的结构示意图为 ;
;
Z的氢化物为NH3,结构式为 ;U为S元素,在周期表中的位置:第三周期VIA族;Na2O2中含有的化学键有:离子键、共价键;
;U为S元素,在周期表中的位置:第三周期VIA族;Na2O2中含有的化学键有:离子键、共价键;
故答案为: ;
; ;
; ;第三周期VIA族;离子键、共价键;
;第三周期VIA族;离子键、共价键;
(2)H、C、N、O四种元素(按顺序)可组成原子个数比为5:1:1:3的化合物,该化合物为NH4HCO3,NH4HCO3的稀溶液与足量氢氧化钠溶液反应的离子方程式为:NH4++HCO3-+2OH-=NH3.H2O+CO32-,
故答案为:NH4++HCO3-+2OH-=NH3.H2O+CO32-.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,难度不大.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:解答题
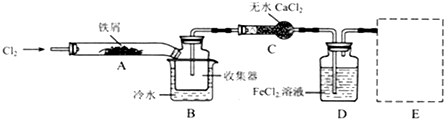
 、Cl2+2OH-=Cl-+ClO-+H2O.
、Cl2+2OH-=Cl-+ClO-+H2O.| 实验步骤 | 实验现象 | 实验结论及反应离子方程式 |
| ①取少量所得溶液于试管中,加入少量KSCN溶液. | 溶液中出现红色. | 说明:假设②不成立,假设①或③成立; 反应的离子方程式是Fe3++3SCN-=Fe(SCN)3. |
| ②另取少量所得溶液于试管中,加入少量酸性 KMnO4溶液. | 溶液紫红色退去 | 说明:假设②或③成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 HCN+OH-
HCN+OH-查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可利用过滤的方法分离胶体和溶液 | |
| B. | 胶体中分散质粒子直径大小在1~100nm之间 | |
| C. | 可以利用丁达尔效应区分胶体和溶液 | |
| D. | 胶体在一定条件下能稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 三乙酸甘油酯是一种优良的溶剂、定香剂和增塑剂.实验室制备三乙酸甘油酯的反应原理、实验装置及相关数据如下:3CH3COOH+
三乙酸甘油酯是一种优良的溶剂、定香剂和增塑剂.实验室制备三乙酸甘油酯的反应原理、实验装置及相关数据如下:3CH3COOH+ $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ +3H2O
+3H2O| 物质 | 相对 分子质量 | 密度/g•cm-3 | 沸点/℃ | 水中 溶解性 |
| 甘油 | 92 | 1.2636 | 290 (分解) | 溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 三乙酸甘油酯 | 218 | 1.1596 | 258 | 不溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com