
ǿ����ǿ���ϡ��Һ�����кͷ�Ӧ����ЧӦΪ��H+(aq)+OH��(aq)=H2O ( l ) ��H=��57.3 kJ / mol
�ֱ���1 L 0.5 mol / L��NaOH��Һ�м��룺��ϡ�����Ũ�����ϡ���ᣬǡ����ȫ��Ӧʱ��Ӧ�ȷֱ�Ϊ��H1����H2����H3�����ǵĹ�ϵ��ȷ����
A����H1����H3����H2 B����H1����H2����H3
C����H1����H2����H3 D����H1����H3����H2
A
��������
�����������ϡ������������ʵ�����Ҫ������������˷�Ӧ��С��57.3 kJ / mol����Ũ��������ˮ��ų������������NaOH��Ӧʱ�ų�����������57.3 kJ / mol����ϡ������ˮ����ȫ���룬������H+��OH-�����кͷ�Ӧ�ų�����������57.3 kJ / mol��������ǵĹ�ϵ��ȷ���Ǧ�H1����H3����H2��ѡ��ΪA��
���㣺���鷴Ӧ������Һ��Ũ�ȡ�����ʵ�ǿ���Ĺ�ϵ��֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014�Ĵ�ʡ�ɶ��иߵڶ�����ĩ��һ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��ˮ���ۺ����ÿ����Ʊ������ƺ�þ�ȣ�����������ͼ��ʾ��
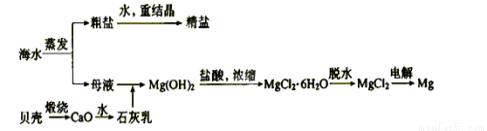
����˵������ȷ���� �� ��
A����ˮ���ζ����������仯
B������ĸҺ�ɽ�һ����ȡ�壬��Ҫ����
C����������������Mg(OH)2���������ӷ���ʽΪ��Mg2++Ca(OH)2= Mg(OH)2+Ca2+
D�����õ��MgO����ȡþ����ΪMgO�۵�ߣ��ܺĴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�Ĵ�ʡ�ɶ�����У��һ��ѧ������������ѧ�Ծ��������棩 ���ͣ�ѡ����
���и�����������ԭ�Ӷ����������Ϊ8���ӽṹ���ǣ�������
A��BeCl2 B��BF3 C��PCl5 D��CCl4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�Ĵ�ʡ�˲��д������п��Ը߶���ѧ�Ծ��������棩 ���ͣ�ѡ����
���з����У���ԭ�Ӿ�����ͬһƽ���ϵ���
A��NH3 B��CCl4 C��SO32�� D��CH2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�Ĵ�ʡ�˲��д������п��Ը߶���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����Ƕ�Ԫ���ᣬ���������Һ�����ԡ���0.1mol��L��1 KHC2O4��Һ�У����й�ϵ��ȷ����
A��c(K+)+c(H+) = c(HC2O4��)+c(OH��)+c(C2O42��)
B��c(HC2O4��)+c(C2O42��) = 0.1 mol��L��1
C��c(C2O42��) < c(H2C2O4)
D��c(K+) = c(H2C2O4)+c(HC2O4��)+c(C2O42��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�Ĵ�ʡ����5�³�̾����ۻ�ѧ�Ծ��������棩 ���ͣ��ƶ���
��15�֣��л���E��ͭ�����������һ�ֿɷ���ķ�����ϣ��ڷ������ķ����кܺõ�Ӧ��ǰ������ϳ�E��·�����£�
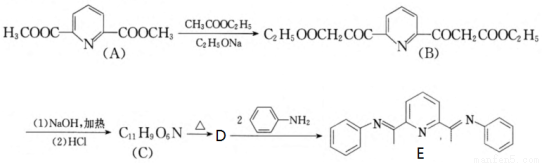
�ش��������⣺
��1��B��C�ķ�Ӧ������ ��
��2��A�ж���ͬ���칹�壬���з������������Ĺ��� �֡�
�ٷ����к�����ऻ�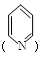 �һ���ֻ��2��ȡ������
�һ���ֻ��2��ȡ������
��ֻ����һ�ֹ����ţ��Һ˴Ź�������ֻ�����ַ壻
����ऻ��ϵ�һ��ȡ����ֻ��2�֡�
��3��C����D�Ĺ�������һ�������������ɣ���D�Ľṹ��ʽΪ ��
��4��д��D����E�Ļ�ѧ����ʽ ��
��5����������Ϣ����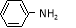 ��
��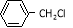 Ϊԭ�Ϻϳ������N�����������ǰ���
Ϊԭ�Ϻϳ������N�����������ǰ���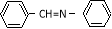 ������������ϳ�·�ߣ� ��
������������ϳ�·�ߣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�Ĵ�ʡ����5�³�̾����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
������ͼ��ת����ϵ�ж�����˵����ȷ���ǣ���Ӧ��������ȥ��

A����Ӧ�٢ڢۢܢݾ�����������Ӧ�����ӷ�Ӧ
B����Ӧ��˵�������������Ļ�ԭ��ǿ����
C����ͬ���������ɵ�����O2����Ӧ�ۺ͢�ת�Ƶĵ�����֮��Ϊ1:1
D����Ӧ�����������뻹ԭ�������ʵ���֮��Ϊ1:4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�����и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
a��b��c��d�����ֶ�����Ԫ�ء�a��b��dͬ���ڣ�c��dͬ���塣a��ԭ�ӽṹʾ��ͼΪ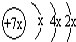 ��b��c�γɻ�����ĵ���ʽΪ
��b��c�γɻ�����ĵ���ʽΪ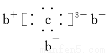 �����бȽ�����ȷ����(����)
�����бȽ�����ȷ����(����)
A��ԭ�Ӱ뾶��a>c>d>b B������������Ӧˮ��������ԣ�c>d>a
C��ԭ��������a>d>b>c D�����ʵ������ԣ�a>b>d>c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�׳��и߶���ѧ����ĩ���Ի�ѧ��B�����Ծ��������棩 ���ͣ������
���ݻ�Ϊ1L���ܱ������У��������·�Ӧ��A��g��+2B��g��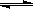 C��g��+D��g�����������1.0molA��2.2molB���ڲ�ͬ�¶��£�D�����ʵ���n��D����ʱ��t�Ĺ�ϵ��ͼ���Իش��������⣺
C��g��+D��g�����������1.0molA��2.2molB���ڲ�ͬ�¶��£�D�����ʵ���n��D����ʱ��t�Ĺ�ϵ��ͼ���Իش��������⣺
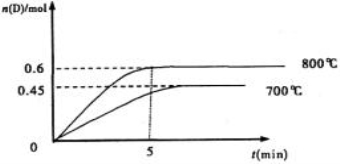
��1��800��ʱ��0��5min�ڣ���B��ʾ��ƽ����Ӧ����Ϊ
��2�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������
A��������ѹǿ���� B�����������c��A������
C��2v����B��=v�棨D�� D��c��A��=c��C��
��3�����������1.0molA��2.2molB������ͼ�����ݼ���800��ʱ��ƽ�ⳣ��K= ��
�÷�ӦΪ ��Ӧ�������Ȼ���ȣ�
��4��700��ʱ��ijʱ�̲����ϵ�и����ʵ������£�n��A��=1.1mol��n��B��=2.6mol��n��C��=0.9mol��n��D��=0.9mol�����ʱ�÷�Ӧ ���У��������Ӧ�������淴Ӧ������ƽ��״̬����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com