
| A. | 不能发生丁达尔效应的分散系有氯化钠溶液、水等 | |
| B. | 将1L 2mol•L-1的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA | |
| C. | 黄河入海口处三角洲的形成与胶体性质有关 | |
| D. | 将饱和FeCl3溶液加热至沸腾,制得Fe(OH)3胶体 |
分析 A、分散系是混合物;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
C、河水是胶体;
D、将饱和氯化铁溶液滴入沸水中制取胶体.
解答 解:A、分散系是混合物,而水是纯净物,故不是胶体,无丁达尔效应,故A错误;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故将1L 2mol•L-1的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数小于2NA,故B错误;
C、河水是胶体,在入海口遇到海水时,由于海水中含电解质氯化钠,故能使河水发生聚沉从而形成三角洲,故C正确;
D、将饱和氯化铁溶液滴入沸水,继续煮沸,至溶液变为红褐色时即可获得氢氧化铁胶体,故D错误.
故选C.
点评 本题考查了胶体的性质和制备,应注意的是一个氢氧化铁胶粒是多个氢氧化铁的聚集体,注意基础的掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
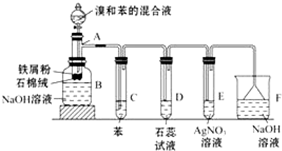 图为苯和溴的取代反应的实验装置图,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉.
图为苯和溴的取代反应的实验装置图,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 | B. | 0.2 mol•L-1 | C. | 0.3 mol•L-1 | D. | 0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
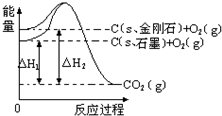
| A. | 石墨和金刚石的转化是物理变化 | |
| B. | C(s、石墨)=C(s、金刚石)△H=+1.9 kJ•mol-1 | |
| C. | 金刚石的稳定性强于石墨 | |
| D. | 1 mol石墨的总键能比1 mol金刚石的总键能小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 400ρmol•L-1 | B. | 20ρmol•L-1 | C. | 2.5ρmol•L-1 | D. | 1.25ρmol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
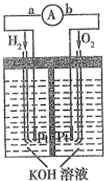 氢氧燃料电池是符合绿色化学理念的新型发电装置.图为电池示意图,该电池电极表面镀一层细小的铂粉(金属铂吸附气体的能力强,性质稳定).请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.图为电池示意图,该电池电极表面镀一层细小的铂粉(金属铂吸附气体的能力强,性质稳定).请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com