
分析 拆开1mol N2中的化学键需消耗946kJ的能量,拆开1mol H2中的H-H键要消耗436kJ的能量,而形成1mol N-H键会放出391kJ的能量,结合反应 N2 +3H2 ?2NH3中各物质的计量数和结构,表示出断键吸收的能量和成键放出的能量,根据反应热△H=断键吸收的热量-成键放出的热量来计算.
?2NH3中各物质的计量数和结构,表示出断键吸收的能量和成键放出的能量,根据反应热△H=断键吸收的热量-成键放出的热量来计算.
解答 解:根据反应N2 +3H2 ?2NH3可知,1mol N2和3molH2完全反应生成2molNH3时,要断裂1molN≡N键和3molH-H键,形成6molN-H键,故△H=断键吸收的能量-成键放出的能量=946kJ+436kJ×3-391kJ×6=-92kJ,故该反应的△H=-92kJ/mol,即反应会放热92KJ,故答案为:92.
?2NH3可知,1mol N2和3molH2完全反应生成2molNH3时,要断裂1molN≡N键和3molH-H键,形成6molN-H键,故△H=断键吸收的能量-成键放出的能量=946kJ+436kJ×3-391kJ×6=-92kJ,故该反应的△H=-92kJ/mol,即反应会放热92KJ,故答案为:92.
点评 本题主要考查了反应热的计算,难度中等,解题关键是运用△H=断键吸收的能量-成键放出的能量来解题,同时应注意在2mol氨气中含6molN-H键是易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | 除去甲苯中的苯甲酸,可以先加入NaOH溶液,充分振荡,然后分液 | |
| B. | 除去C2H5OH中的少量CH3COOH:加足量CaO,蒸馏 | |
| C. | 用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO | |
| D. | 除去乙酸乙酯中的少量乙酸:加入乙醇和浓硫酸将乙酸全部转化为乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当混合气体的质量不再发生变化时,说明反应达到平衡状态 | |
| B. | 用M表示此反应速率是0.1 amol•(L•min)-1 | |
| C. | 用X表示此反应的反应速率是(0.1-0.2 a)mol•(L•min)-1 | |
| D. | 当混合气体的压强不再发生变化时,说明反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
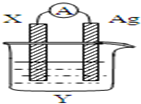 依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
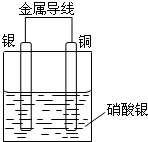 某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.
某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 降低温度可以加快反应速率 | |
| B. | 达到化学反应限度时,生成2mol NH3 | |
| C. | 1mol N2 和3mol H2的总能量低于2mol NH3的总能量 | |
| D. | 向容器中再加入N2可加快正反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol SO2和足量O2反应,必定生成2 mol SO3 | |
| B. | 平衡时,SO2消耗速率必定等于O2生成速率的两倍 | |
| C. | 其他条件不变,增大压强,平衡必定向正反应方向移动 | |
| D. | 平衡时,SO2浓度必定等于O2浓度的两倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com