
| A. | 500 mL溶液中的阴、阳离子总数为0.3NA | |
| B. | 500 mL溶液中NO3-离子浓度为0.2mol/L | |
| C. | 500 mL溶液中Ba2+离子浓度为0.2mol/L | |
| D. | 500 mL溶液中NO3-离子总数为0.2NA |
分析 A、求出500mL溶液中Ba(NO3)2的物质的量,然后根据1molBa(NO3)2含3mol离子来分析;
B、NO3-离子浓度与所取溶液的体积无关;
C、Ba2+离子浓度与所取溶液体积无关;
D、求出500mL溶液中Ba(NO3)2的物质的量,然后根据1molBa(NO3)2含2molNO3-离子来分析.
解答 解:A、500mL溶液中Ba(NO3)2的物质的量n=CV=0.2mol/L×0.5L=0.1mol,而1molBa(NO3)2含3mol离子,故0.1mol硝酸钡中含0.3mol离子即0.3NA个,故A正确;
B、NO3-离子浓度与所取溶液的体积无关,即0.2mol/L Ba(NO3)2溶液中硝酸根的浓度为0.4mol/L,故B错误;
C、Ba2+离子浓度与所取溶液体积无关,即0.2mol/L Ba(NO3)2溶液中钡离子的浓度为0.2mol/L,故C正确;
D、500mL溶液中Ba(NO3)2的物质的量n=CV=0.2mol/L×0.5L=0.1mol,而1molBa(NO3)2含2molNO3-离子,故0.1mol硝酸钡中含0.2NA个硝酸根,故D正确.
故选B.
点评 本题考查了溶液中离子浓度和个数的计算,应注意的是当溶液浓度一定时,离子浓度和所取溶液的体积无关.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
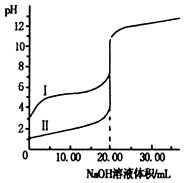 室温下,用0.1mol•L-1 NaOH溶液分别滴定20.00ml0.1mol•L-1的盐酸和醋酸溶液,滴定曲线如图.下列说法正确的是( )
室温下,用0.1mol•L-1 NaOH溶液分别滴定20.00ml0.1mol•L-1的盐酸和醋酸溶液,滴定曲线如图.下列说法正确的是( )| A. | I、Ⅱ分别表示盐酸和醋酸的滴定曲线 | |
| B. | V(NaOH)=10.00mL时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$>1 | |
| C. | pH=7时,两种酸所消耗NaOH溶液的体积相等 | |
| D. | V(NaOH)=20.00mL时,c(Cl一)<c(CH3COO一) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于置换反应 | B. | 碳发生了还原反应 | ||
| C. | 二氧化硅是氧化剂 | D. | 24g碳充分反应生成28g硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
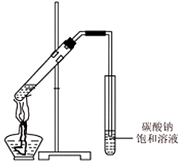 已知:乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.
已知:乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.| 实验现象 | 结 论 | |
| ① | 钠沉在乙醇下面 | 钠的密度大于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
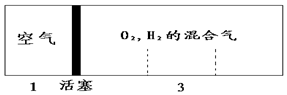 密闭容器中自由移动的活塞两边分别充入空气和H2、O2的混合气体,开始体积比为1:3,若将H2、O2的混合气体点燃引爆,恢复到原来温度(水为液态),活塞右滑停留于容器的正中央,则原来H2、O2的体积比可能为( )
密闭容器中自由移动的活塞两边分别充入空气和H2、O2的混合气体,开始体积比为1:3,若将H2、O2的混合气体点燃引爆,恢复到原来温度(水为液态),活塞右滑停留于容器的正中央,则原来H2、O2的体积比可能为( )| A. | 1:2 | B. | 3:2 | C. | 5:2 | D. | 7:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和Na2CO3 | B. | 稀H2SO4和NaHCO3 | C. | CaCl2和Na2CO3 | D. | Ba(OH)2和NaHSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com