
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。
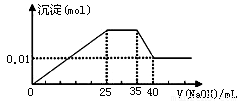
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是
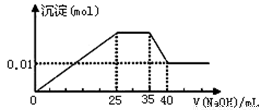
A.原溶液一定不存在H+、Cu2+、CO32-
B.不能确定原溶液是否含有K+、NO3-
C.原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2
D.实验所加的NaOH的浓度为2mol·L-
B
【解析】
试题分析:溶液是无色的,因此一定不存在铜离子。第一份加足量AgNO3溶液后,有白色沉淀产生,这说明溶液中至少含有CO32-、SO42-中的一种。第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。则该办事处是硫酸钡或碳酸钡或是二者的混合物。第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据图像可知,开始立即出现沉淀,这说明不存在大量的氢离子。当沉淀达到最大值时保持不变,这说明加入的氢氧化钠与溶液中的NH4+反应生成一水合氨,因此一定含有NH4+。继续加入氢氧化钠溶液,沉淀开始减少,但不完全消失。这说明沉淀应该是氢氧化镁和氢氧化铝的混合物,所以溶液中一定含有Mg2+、Al3+,则一定不存在CO32-,所以一定还含有SO42-。A、原溶液一定不存在H+、Cu2+、CO32-,A正确;B、硫酸钡的质量是6.99g,物质的量=6.99g÷233g·mol-1=0.03mol。根据图像可知,氢氧化镁的物质的量是0.01mol,则此时氢氧化镁消耗的氢氧化钠应该是0.02mol。溶解氢氧化铝消耗的氢氧化钠溶液体积是5ml,则产生氢氧化铝消耗的氢氧化钠溶液体积15ml。所以产生氢氧化镁消耗的氢氧化钠溶液体积是10mol,所以根据方程式Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓可知,氢氧化镁与氢氧化铝的物质的量相等,都是0.01mol。与NH4+反应的氢氧化钠溶液体积是10ml,所以NH4+的物质的量是0.02mol。根据溶液的电中性可知,溶液中阴离子SO42-的电荷数是0.06mol,而阳离子 的电荷数是0.02mol+0.03mol+0.02mol=0.07mol,所以溶液中一定还含有NO3-,但不能确定原溶液是否含有K+,B不正确;C、原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2,C正确;D、实验所加的NaOH的浓度为0.02mol÷0.01L=2mol·L-1,D正确,答案选B。
考点:考查离子共存、离子检验的有关判断和计算


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
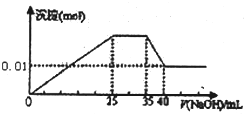 有一未知的无色溶液,只可能含有以下离子中的若干种:H+、NH+4、K+、Mg2+、Cu2+、Al3+、NO-3、CO2-3、SO2-4,现取三份100mL溶液进行如下实验
有一未知的无色溶液,只可能含有以下离子中的若干种:H+、NH+4、K+、Mg2+、Cu2+、Al3+、NO-3、CO2-3、SO2-4,现取三份100mL溶液进行如下实验| A、原溶液一定不存在H+、Cu2+、CO2-3 | B、不能确定原溶液是否含有K+、NO-3 | C、原溶液确定含Mg2+、Al3+、NH+4,且n(Mg2+):n(Al3+):n(NH+4)=1:1:2 | D、实验所加的NaOH的浓度为2 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、SO
、SO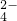 ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
 +,其物质的量之比n(Mg2+):n(Al3+):n(NH
+,其物质的量之比n(Mg2+):n(Al3+):n(NH +)=______.
+)=______. -的物质的量为n (NO3-),则n(NO3-)的取值范围为:______.
-的物质的量为n (NO3-),则n(NO3-)的取值范围为:______.查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省温州市十校联合体高三上学期期末考试理综化学试卷(解析版) 题型:选择题
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。[
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是
A.原溶液一定不存在H+、Cu2+、CO32-
B.不能确定原溶液是否含有K+、NO3-
C.原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2
D.实验所加的NaOH的浓度为2mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com