
| ||
| ||
| 6 |
| 5 |


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
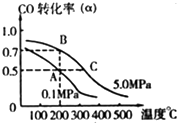 (1)金属铜与人体分泌物中的盐酸以及体内的空气反应可生成超氧酸:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示错误的是
(1)金属铜与人体分泌物中的盐酸以及体内的空气反应可生成超氧酸:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性.下列说法或表示错误的是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol?L-1 |
| B、1mol?L-1 |
| C、0.5mol?L-1 |
| D、0.05mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3>H2O>CH4 |
| B、CH4>NH3>H2O |
| C、CH4>H2O>NH3 |
| D、H2O>CH4>NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl比H2S稳定 |
| B、HClO4的酸性比H2SO4的酸性强 |
| C、向Na2S溶液中通入Cl2,溶液变浑浊 |
| D、向新制氯水中滴加Na2SO3溶液,氯水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁器生锈、铜器长出“铜绿”、银制器皿表面变暗,都属于金属腐蚀 |
| B、生铁比软铁芯(几乎是纯铁)容易生锈 |
| C、铆在铜板上的铁钉在潮湿空气中容易生锈 |
| D、家用炒菜铁锅用水清洗放置后出现的锈斑主要成分是Fe3O4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com