
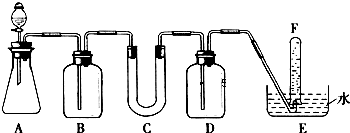
| ŅĒĘ÷ | ¼ÓČėŹŌ¼Į | ¼ÓČėøĆŹŌ¼ĮµÄÄæµÄ |
| B | ±„ŗĶNaHCO3ČÜŅŗ | |
| C | ||
| D |
·ÖĪö ÓÉŹµŃé×°ÖĆæÉÖŖ£¬±¾ŹµŃéŹ×ĻČÓÉCaCO3ŗĶŃĪĖį·“Ӧɜ³ÉCO2£¬²śÉśĘųĢåĶعż±„ŗĶNaHCO3ČÜŅŗ£¬ŅŌ³żČ„CO2ĘųĢåÖŠ»ģČėµÄHCl£¬Č»ŗó¹żŃõ»ÆÄĘÓėCO2ŗĶĖ®Ęų·“Ó¦£¬²śÉśO2£¬ÓĆÅÅĖ®·ØŹÕ¼ÆO2£¬×īŗóČ”³öŹŌ¹Ü£¬Į¢¼“°Ń“ų»šŠĒµÄľĢõÉģČėŹŌ¹ÜæŚÄŚ£¬Ä¾Ģõø“Č¼£¬Ö¤Ć÷ŹŌ¹ÜÖŠŹÕ¼ÆµÄĘųĢåŹĒŃõĘų£®
½ā“š ½ā£ŗ£Ø1£©AĪŖÓÉCaCO3ŗĶŃĪĖį·“Ӧɜ³ÉCO2£¬·½³ĢŹ½ĪŖCaCO3+2HCl=CaCl2+H2O+CO2”ü£¬
¹Ź“š°øĪŖ£ŗCaCO3+2HCl=CaCl2+H2O+CO2”ü£»
£Ø2£©²śÉśĘųĢåĶعż±„ŗĶNaHCO3ČÜŅŗ£¬ŅŌ³żČ„CO2ĘųĢåÖŠ»ģČėµÄHCl£¬Č»ŗó¹żŃõ»ÆÄĘÓėCO2ŗĶĖ®Ęų·“Ó¦£¬²śÉśO2£¬ÓÉÓŚÉś³ÉµÄŃõĘųÖŠ»ģÓŠ¶žŃõ»ÆĢ¼ĘųĢ壬ӦÓĆNaOHČÜŅŗĻ“Ęų£¬ĪüŹÕĪ“·“Ó¦µÄCO2ĘųĢ壬ÓĆÅÅĖ®·ØŹÕ¼ÆO2£¬
¹Ź“š°øĪŖ£ŗ
| ŅĒĘ÷ | ¼ÓČėŹŌ¼Į | ¼ÓČėøĆŹŌ¼ĮµÄÄæµÄ |
| B | ±„ŗĶNaHCO3ČÜŅŗ | ³żČ„CO2ĘųĢåÖŠ»ģČėµÄHCl |
| C | ¹żŃõ»ÆÄĘ | ÓėCO2ŗĶĖ®Ęų·“Ó¦£¬²śÉśO2 |
| D | NaOHČÜŅŗ | ĪüŹÕĪ“·“Ó¦µÄCO2ĘųĢå |
µćĘĄ ±¾Ģāæ¼²é¹żŃõ»ÆÄʵĊŌÖŹµÄŹµŃéÉč¼Ę£¬ĢāÄæÄŃ¶Č²»“󣬽ā“š±¾Ģā×¢Ņā°ŃĪÕŹµŃéŌĄķŗĶĻą¹ŲŹµŃéµÄ»ł±¾²Ł×÷£¬×¢Ņā³żŌÓµÄĻČŗóĖ³ŠņŗĶ¼ģŃéŃõĘųµÄ²Ł×÷·½·Ø£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ū¢Ż¢ß | B£® | ¢Ł¢Ś¢Ü¢ą | C£® | ¢Ś¢Ū¢Ž¢ą | D£® | ¢Ł¢Ś¢Ž¢ą |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| Ń”Ļī | ŹµŃé²Ł×÷ | ŹµŃéĻÖĻó | ½āŹĶ»ņ½įĀŪ |
| A | ½«ĀĮĖæ·ÅČėÅØĮņĖįÖŠ | ĪŽĆ÷ĻŌĻÖĻó | ĀĮĖæ·¢ÉśĮĖ¶Ū»Æ |
| B | ½«SO2ĶØČė¹żĮæµÄNa2CO3ČÜŅŗÖŠ£¬½«²śÉśµÄĘųĢåŌŁĶØČėNa2SiO3ČÜŅŗÖŠ | ÓŠ°×É«³ĮµķÉś³É | Ö¤Ć÷ĖįŠŌ£ŗH2SO3£¾H2CO3£¾H2SiO3 |
| C | Ļņŗ¬ÓŠFe3+µÄČÜŅŗÖŠµĪ¼ÓKSCNČÜŅŗ | ČÜŅŗ±äŗģÉ« | ÓŠFe£ØSCN£©3Éś³É |
| D | ĻņKOHČÜŅŗÖŠµĪ¼Ó×ćĮæµÄMgSO4ČÜŅŗ£¬Č»ŗóŌŁµĪ¼Ó×ćĮæµÄFeCl3ČÜŅŗ | ĻČ²śÉś°×É«³Įµķ£¬Č»ŗó³Įµķ±äŗģŗÖÉ« | Ksp[Fe£ØOH£©3]£¾Ksp[Mg£ØOH£©2] |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | µŚĖÄÖÜĘŚŌŖĖŲÖŠ£¬ĆĢŌ×Ó¼Ūµē×Ó²ćÖŠĪ“³É¶Ōµē×ÓŹż×ī¶ą | |
| B£® | µŚ¶žÖÜĘŚÖ÷×åŌŖĖŲµÄŌ×Ó°ė¾¶ĖęŗĖµēŗÉŹżŌö“óŅĄ“Ī¼õŠ” | |
| C£® | Ā±ĖŲĒā»ÆĪļÖŠ£¬HClµÄ·Šµć×īµĶµÄŌŅņŹĒĘä·Ö×Ó¼äµÄ·¶µĀ»ŖĮ¦×īŠ” | |
| D£® | ¼Ū²ćµē×Ó¶ŌĻą³āĄķĀŪÖŠ£¬¦Š¼üµē×Ó¶ŌŹż²»¼ĘČėÖŠŠÄŌ×ӵļŪ²ćµē×Ó¶ŌŹż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
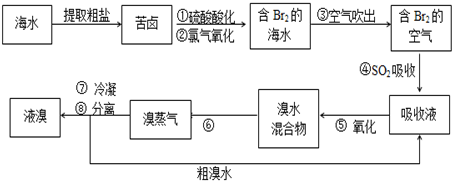
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
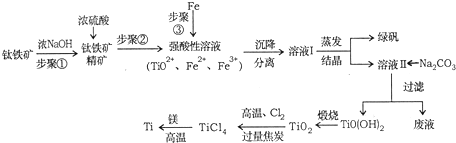
| PH | Fe£ØOH£©3 | Fe£ØOH£©2 | Mg£ØOH£©2 | TiO£ØOH£©2 |
| æŖŹ¼³Įµķ | 1.1 | 4.5 | 7 | 1 |
| ĶźČ«³Įµķ | 2.8 | 6.4 | 9.2 | 2.7 |
| TiCl4 | Mg | MgCl2 | Ti | |
| ČŪµć/ | -25.0 | 648.8 | 714 | 1667 |
| ·Šµć/ | 136.4 | 1090 | 1412 | 3287 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
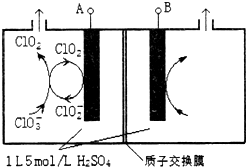 ¶žŃõ»ÆĀČ£ØClO2£©ŹĒ¹śÄŚĶā¹«ČĻµÄøߊ§”¢¹ćĘ×”¢æģĖŁ”¢°²Č«ĪŽ¶¾µÄɱ¾śĻū¶¾¼Į£¬±»³ĘĪŖ”°µŚ4“śĻū¶¾¼Į”±£®¹¤ŅµÉĻæɲÉÓĆĀČĖįÄĘ£ØNaClO3£©»ņŃĒĀČĖįÄĘ£ØNaClO2£©ĪŖŌĮĻÖʱøClO2£®
¶žŃõ»ÆĀČ£ØClO2£©ŹĒ¹śÄŚĶā¹«ČĻµÄøߊ§”¢¹ćĘ×”¢æģĖŁ”¢°²Č«ĪŽ¶¾µÄɱ¾śĻū¶¾¼Į£¬±»³ĘĪŖ”°µŚ4“śĻū¶¾¼Į”±£®¹¤ŅµÉĻæɲÉÓĆĀČĖįÄĘ£ØNaClO3£©»ņŃĒĀČĖįÄĘ£ØNaClO2£©ĪŖŌĮĻÖʱøClO2£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
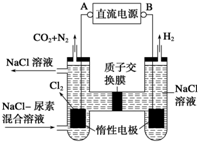
| A£® | A ¼«ĪŖµēŌ“µÄøŗ¼« | |
| B£® | Ńō¼«ŹŅÖŠ·¢ÉśµÄ·“Ó¦Ö»ÓŠCO£ØNH2£©2-6e-+6OH -=N2”ü+CO2”ü+5H2O | |
| C£® | Ņõ¼«ŹŅČÜŅŗµÄ PH µē½āĒ°ŗó±£³Ö²»±ä | |
| D£® | ³żČ„ 3.6 æĖÄņĖŲŹ±Ņõ¼«Ņ»¶ØÉś³É H26.72L |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com