
 已知A、B、C、D都是周期表中的短周期元素,它们的核电荷数依次增大.A原子、C原子的L电子层中,都有两个未成对的电子,C、D同主族.E、F都是第四周期元素,E原子核外有4个未成对电子,F原子的外围电子排布式为3d104s1.请填空:
已知A、B、C、D都是周期表中的短周期元素,它们的核电荷数依次增大.A原子、C原子的L电子层中,都有两个未成对的电子,C、D同主族.E、F都是第四周期元素,E原子核外有4个未成对电子,F原子的外围电子排布式为3d104s1.请填空:| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、1-2.25a% |
| B、2.25a% |
| C、1-1.75a% |
| D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

| A、将水准管上提,液面高于量气管且不下降,说明装置不漏气 |
| B、若已知参加反应的Zn的质量,则该装置可用来测定气体摩尔体积 |
| C、若已知参加反应的Zn的质量,则该装置可用来测定锌的相对原子质量 |
| D、反应停止后,立即读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业.工业上利用TiO2制备金属钛的流程如下.
TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业.工业上利用TiO2制备金属钛的流程如下.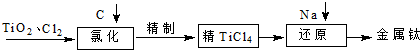
| 物质 | TiCl4 | FeCl3 | SiCl4 | AlCl3 |
| 沸点/℃ | 136 | 310 | 56.5 | 180 |
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
2- 3 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
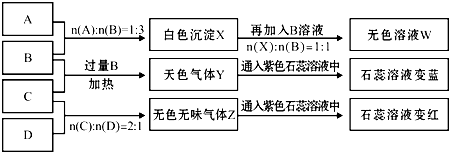
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称取3.84 g CuSO4粉末,加入250 mL水 |
| B、称取6.25 g CuSO4?5H2O晶体,加水配成250 mL溶液 |
| C、称取4.0 g CuSO4粉末,加入250 mL水 |
| D、称取4.0 g CuSO4?5H2O晶体,加水配成250 mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com