
| 1.6g |
| 160g/mol |
| 10.44g |
| 174g/mol |
| 3.96g-0.02mol×56g/mol-0.04mol×39g/mol |
| 16g/mol |
| 1.6g |
| 160g/mol |
| 10.44g |
| 174g/mol |
| 3.96g-0.02mol×56g/mol-0.04mol×39g/mol |
| 16g/mol |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Ca2+、Na+、CO32- |
| B、Mg2+、Al3+、SO42-、Cl- |
| C、Cu2+、Mg2+、Cl-、OH- |
| D、K+、Na+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| B、向稀Fe(NO3)2和NaBr混合溶液中滴加稀盐酸6Br-+8H++2NO3-=3Br2+2NO↑+4H2O |
| C、Na2S溶液中滴加NaClO溶液:S2-+ClO-+H2O=S↓+Cl-+2OH- |
| D、双氧水使酸性KMnO4溶液褪色2MnO4-+5H2O2=2Mn2++5O2↑+6OH-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发操作可以从溶液中分离得到可溶性固体溶质 |
| B、将待过滤的液体直接倒入漏斗中,且使液面低于滤纸边缘 |
| C、可以使用分液的方法分离植物油和水的混合物,植物油从分液漏斗上口倒出 |
| D、蒸馏操作时,温度计的水银球不能伸入液面以下,应在蒸馏烧瓶的支管口处 |
查看答案和解析>>
科目:高中化学 来源: 题型:
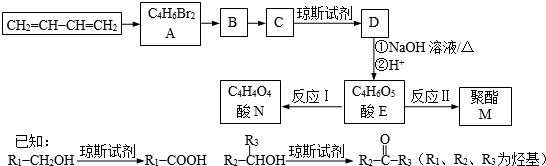
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①和② | B、②和③ |
| C、③和④ | D、④和⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+和CO32- |
| B、HCO3-和HSO4- |
| C、Na+、HCO3-和H+ |
| D、HCO3-和H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com