
| A、18gD2O中含有质子的数目为NA |
| B、标准状况下,11.2L甲烷和乙烯的混合物所含氢原子的数目为2NA |
| C、1L0.1mol?L-1CH3COOH溶液中含有分子的数目小于0.1NA |
| D、1L0.5 mol?L-1Na2CO3溶液中含有CO32-的数目为0.5NA |
| 18g |
| 20g/mol |
| 11.2L |
| 22.4L/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
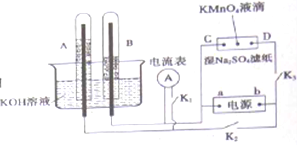 化学反应原理在科研和生产中有广泛应用.
化学反应原理在科研和生产中有广泛应用.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④① | B、②①③④ |
| C、③②④① | D、③②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaCl2 和(NH4)2C03 |
| B、AgNO3 和 NH4Cl |
| C、FeCl3和 NaHCO3 |
| D、KCl 和 Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
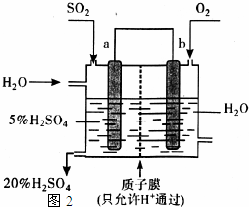 在硫酸工业中,SO2转化为SO3是一个关键步骤.
在硫酸工业中,SO2转化为SO3是一个关键步骤.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.4克金属镁变成镁离子时失去的电子数目为0.1NA(NA代表阿伏加德罗常数) |
| B、40g NaOH溶解于500mL水中,所得溶液的物质的量浓度为2mol?L-1 |
| C、1mol H2的质量是2g?mol-1 |
| D、等物质的量的O3和H2O中所含的原子个数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
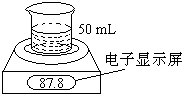 某学生用电子天平和必要的化学实验仪器测定铁铝合金中各组分含量,其实验装置如图所示:实验时,取一块铁铝合金,将其切成碎块后全部加入到盛有50mL 5.0mol?L-1 NaOH溶液的烧杯中.试回答下列问题:
某学生用电子天平和必要的化学实验仪器测定铁铝合金中各组分含量,其实验装置如图所示:实验时,取一块铁铝合金,将其切成碎块后全部加入到盛有50mL 5.0mol?L-1 NaOH溶液的烧杯中.试回答下列问题:| 实验操作过程 | 时间/min | 电子天平的读数/g |
| 烧杯+NaOH溶液 | 80.0 | |
| 烧杯+溶液+样品 | 0 | 87.8 |
| 1 | 87.5 | |
| 2 | 87.3 | |
| 3 | 87.2 | |
| 4 | 87.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com