
分析 (1)利用m=n×M来计算质量及质量之比,分子数之比等于物质的量之比,利用分子的构成来计算氧原子个数之比,根据体积V=nVm来计算体积比;
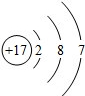
(2)根据质子数=质量数-中子数计算X原子质子数,确定1molHmX中所含质子的物质的量.
解答 解:(1)氧气与臭氧的质量之比为0.6mol×32g/mol:0.4mol×48g/mol=1:1,因分子数之比=物质的量之比=标准状况下体积比=0.6mol:0.4mol=3:2,又1个氧分子中含有2个氧原子,1个臭氧分子中含3个氧原子,则氧原子个数之比为0.6mol×2:0.4mol×3=1:1,
故答案为:1:1;1:1;3:2;
(2)某元素的一种同位素X的原子质量数为a,含N个中子,则质子数为(a-N),则每1molHmX分子含有质子数为(a-N+m)mol,故答案为:a-N+m.
点评 本题考查物质的量的计算,难度不大,学生明确质量、摩尔质量、物质的量的关系及物质的构成即可解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ||||||||
| 二 | A | B | C | |||||
| 三 | D | E | F | G |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | C+H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO+H2 | ||
| C. | Cl2+H2O═HCl+HClO | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编 号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30g丙醇中存在的共价键总数为5NA | |
| B. | 密闭容器中2mol NO与1mol O2充分反应,转移的电子数为2NA | |
| C. | 常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子总数为2NA | |
| D. | 2.8g乙烯和环丁烷(C4H8)的混合气体中含有的原子总数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫常用来漂白纸浆 | B. | 漂粉精可用于游泳池的消毒 | ||
| C. | 明矾常用于水质消毒 | D. | 氧化铁常用作红色油漆和涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com