
分析 (1)干冰中碳原子与氧原子之间形成2对共用电子对;
(2)由题目信息可知,CO2与NH3反应生成NH2COONH4;
(3)NH2COONH4转化为CO(NH2)2,由原子守恒可知还生成H2O;
(4)CO2中碳元素化合价为+4价,具有氧化性,H2具有还原性;
(5)NaHCO3、Fe与H2O反应可生成CH4,C元素发生还原反应,则Fe发生氧化反应生成四氧化三铁,还应有NaOH生成;
(6)一份固体加入减轻的质量为结晶水的质量及碳酸氢钠分解生成的二氧化碳、水的质量质量之和;另一份加入酸后用石灰水吸收气体,生成的10g白色沉淀为碳酸钙的质量,结合每份样品总质量列方程计算解答;
(7)BaSO4与碳酸钠反应得到BaCO3与硫酸钠.
解答 解:(1)干冰中碳原子与氧原子之间形成2对共用电子对,结构式为O=C=O,
故答案为:O=C=O;
(2)由题目信息可知,CO2与NH3反应生成NH2COONH4,反应方程式为:CO2+2NH3═NH2COONH4,
故答案为:CO2+2NH3═NH2COONH4;
(3)NH2COONH4转化为CO(NH2)2,由原子守恒可知还生成H2O,反应方程式为:NH2COONH4 $\frac{\underline{\;\;△\;\;}}{\;}$ CO(NH2)2+H2O,
故答案为:NH2COONH4 $\frac{\underline{\;\;△\;\;}}{\;}$CO(NH2)2+H2O;
(4)CO2中碳元素化合价为+4价,具有氧化性,H2具有还原性,所以从氧化还原反应的角度说明该推测具有一定的合理性,
故答案为:CO2中碳元素化合价为+4价,具有氧化性,H2具有还原性,所以从氧化还原反应的角度说明该推测具有一定的合理性;
(5)NaHCO3、Fe与H2O反应可生成CH4,C元素发生还原反应,则Fe发生氧化反应生成四氧化三铁,还应有NaOH生成,反应方程式为:NaHCO3+3Fe+2H2O$\frac{\underline{\;高温高压\;}}{\;}$CH4+NaOH+Fe3O4,
故答案为:NaHCO3+3Fe+2H2O$\frac{\underline{\;高温高压\;}}{\;}$CH4+NaOH+Fe3O4;
(6)设11.30g矿物中Na2CO3、NaHCO3、H2O的物质的量分别为amol、bmol、cmol,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O 固体质量减少
2mol 62g
bmol 31b g
则31b+18c=11.3-7.95=3.35
另一份加入酸后用石灰水吸收气体,生成的10g白色沉淀为碳酸钙的质量,根据碳原子守恒则a+b=$\frac{10}{100}$=0.1
由样品质量可得:106a+84b+18c=11.3,
联立方程解得a=0.05、b=0.05、c=0.1,
故该矿物的化学式是Na2CO3•NaHCO3•2H2O,
故答案为:Na2CO3•NaHCO3•2H2O;
(7)BaSO4不溶于酸,若用饱和Na2CO3溶液处理可转化为溶于酸的BaCO3,沉淀转化反应的离子方程式是:BaSO4+CO32-=BaCO3+SO42-,
故答案为:BaSO4+CO32-=BaCO3+SO42-.
点评 本题考查混合物计算、化学方程式书写、氧化还原反应、沉淀转化等,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Pb为正极被氧化 | B. | SO42-只向PbO2处移动 | ||
| C. | Pb电极质量减少 | D. | 电解质溶液的pH不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质溶液的导电性强弱是由浓度决定的 | |
| B. | 弱电解质和强电解质的导电,都是由带电离子的定向移动引起的 | |
| C. | 强电解质溶液导电能力强,弱电解质溶液导电能力弱 | |
| D. | 导电性强的溶液中的自由移动离子数目一定比导电性弱的溶液中的自由移动离子数目多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 17gNH3中含有的质子数为10NA | |
| B. | 标准状况下,22.4LCl2与56gFe反应生成FeCl2分子的数目为NA | |
| C. | 7.0g丁烯含有C-H键的数目为NA | |
| D. | 常温下,1.0LpH=1的H2SO4溶液中,由水电离出的0H-的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
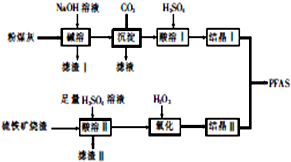 聚合硫酸铝铁[AlaFeb(OH)m(SO4)n•xH2O,简称PFAS]是一种新型高效水处理剂,以硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)和粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为主要原料制备PFAS的工艺流程如下:
聚合硫酸铝铁[AlaFeb(OH)m(SO4)n•xH2O,简称PFAS]是一种新型高效水处理剂,以硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)和粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为主要原料制备PFAS的工艺流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com