
【题目】向10 mL某浓度的AlCl3溶液中滴加1.5 mol·L-1的NaOH溶液时,得到Al(OH)3沉淀的质量(g)与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
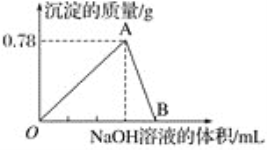
(1)图中B点溶液中的溶质有________________。
(2)O点到B点反应的总离子方程式可表示为________________。
(3)反应至A点时消耗NaOH溶液的体积为______________。
(4)AlCl3溶液的浓度为______________。
【答案】NaAlO2、NaCl Al3++4OH-=![]() +2H2O 20 mL 1 mol·L-1
+2H2O 20 mL 1 mol·L-1
【解析】
根据图像发生的离子方程式为Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,据此分析解答。
(1)根据图像发生的离子方程式为Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O,B点溶质为NaCl、NaAlO2;
(2)根据(1),O点到B点总反应的离子方程式为Al3++4OH-=AlO2-+2H2O;
(3)OA点发生:Al3++3OH-=Al(OH)3↓,根据图像,得到Al(OH)3的质量为0.78g,物质的量为0.01mol,根据反应方程式,消耗NaOH的物质的量为0.03mol,即消耗NaOH的体积为![]() =0.02L,应为20mL;
=0.02L,应为20mL;
(4)利用元素守恒,n(AlCl3)=n[Al(OH)3]=0.01mol,则c(AlCl3)=![]() =1mol·L-1。
=1mol·L-1。


科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是( )
A.1molK2Cr2O7被还原为Cr3+转移的电子数为3NA
B.0.1molCH4与Cl2在光照下反应生成的CH3Cl分子数为0.1NA
C.常温常压下,124gP4中所含P-P键数目4NA
D.标准状况下,22.4L丙烷中所含共价键数目为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作为补血剂,铁红(Fe2O3)可作为颜料。利用某硫酸厂产生的烧渣(主要含FeCO3、FeO,还有一定量的SiO2)制备碳酸亚铁的流程如图:
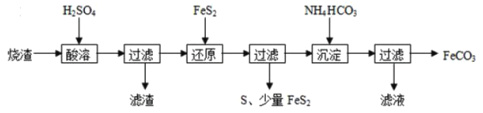
(1)“酸溶”时加快反应速率的方法有____(写出一种)。
(2)①“还原”时,FeS2与H2SO4不反应,Fe3+通过两个反应被还原,其中一个反应如下:FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+,则另一个反应的离子方程式为:___。
②FeS2还原后,检验Fe3+是否反应完全的方法是___。
(3)①“沉淀”时,需控制pH不宜过高,否则生成的FeCO3中可能混有___杂质;
②能否将NH4HCO3换成(NH4)2CO3___。
(4)FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,同时释放出CO2,则与FeCO3反应的物质为___(填化学式)。
(5)FeCO3在空气中煅烧生成Fe2O3时,也会生成FeO。现煅烧34.8g的FeCO3,得到Fe2O3和FeO的混合物23.76g,则Fe2O3的质量为___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2=Fe3++2H2O
B.氯气与水反应:Cl2 + H2O![]() 2H+ + Cl- + ClO-
2H+ + Cl- + ClO-
C.碳酸钙与醋酸溶液反应:CaCO3+2H+=Ca2++CO2↑+H2O
D.向A12(SO4)3溶液中加入过量的氨水:A13++3NH3·H2O=A1(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主知识产权的首套煤基乙醇工业化项目的生产过程:先用煤制得乙酸甲酯,再将乙酸甲酯转化为乙醇。乙酸甲酯转化为乙醇涉及反应原理:
主反应:CH3COOCH3(g)+2H2(g)![]() C2H5OH(g)+CH3OH(g) ΔH1=-23.61kJmol-1
C2H5OH(g)+CH3OH(g) ΔH1=-23.61kJmol-1
副反应:CH3COOCH3(g)+C2H5OH(g)![]() CH3COOC2H5(g)+CH3OH(g) ΔH2=0.99kJmol-1
CH3COOC2H5(g)+CH3OH(g) ΔH2=0.99kJmol-1
在催化剂作用下的反应历程为(*表示吸附态)
化学吸附:H2→2H*
表面反应:CH3COOCH3+4H*→CH3CH2OH*+CH3OH*
化学脱附:CH3CH2OH*→CH3CH2OHCH3OH*→CH3OH
已知:化学吸附的活化能大,决定主反应的反应速率。
(1)2CH3COOCH3(g)+2H2(g)![]() CH3COOC2H5(g)+2CH3OH(g) ΔH3则ΔH3=___。
CH3COOC2H5(g)+2CH3OH(g) ΔH3则ΔH3=___。
(2)下列条件,有利于提高C2H5OH平衡产率的是___。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(3)在1L密闭容器中充入1mol乙酸甲酯,乙酸甲酯的平衡转化率与温度和氢酯比(x)[x=![]() ]的关系如图1。
]的关系如图1。
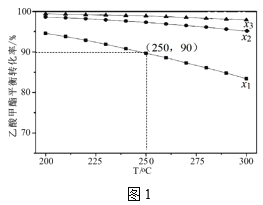
①x1、x2、x3的大小关系为___。
②250℃、x1=10,C2H5OH的选择性为60%,则主反应的平衡常数为___(保留2位有效数字)。(如乙醇选择性=![]() )
)
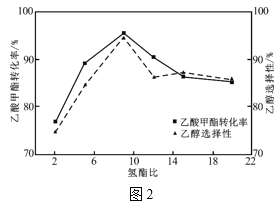
(4)其它条件相同,反应经过相同时间,乙酸甲酯的转化率与乙醇的选择性随氢酯比的关系如图2所示。氢酯比(x)在2~9之间,乙醇的选择性逐渐增大的原因为___。
(5)若仅发生主反应,在恒压条件下,充入乙酸甲酯和氢气各2mol一段时间后达平衡,若在t1时刻再充入各1mol的反应物(其它条件不变),t2时重新达到平衡,请在图3中画出t1~t3的正逆反应速率变化的示意图。___。
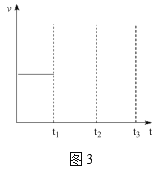
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由三种元素组成的化合物A,按如图流程进行实验:
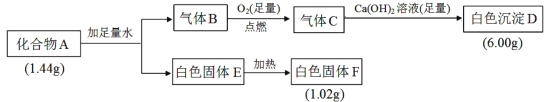
已知:①气体B为纯净物。②固体E既能溶于NaOH溶液又能溶于盐酸。
请回答:
(1)组成A的三种元素是___,A的化学式是___。
(2)固体A与足量稀盐酸反应的化学方程式是___。
(3)气体B与足量CuO在加热条件下反应,请写出一个可能的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验所选择的装置或仪器(夹持装置已略去)不能达到实验目的的是( )
A.利用图装置制备并收集乙酸乙酯
B.利用图装置探究SO2的氧化性和漂白性
C.利用图装置收集氨气并进行尾气吸收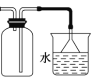
D.利用图装置从苯和溴苯的混合溶液中分离出溴苯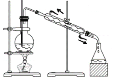
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种温室气体,对人类的生存环境产生巨大的影响,维持大气中CO2的平衡对生态环境保护有着重要意义。
(1)CO2加氢合成低碳烯烃技术能有效利用CO2,以合成C2H4为例。该转化分为两步进行:
第一步:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH1=+41.3kJ/mol
CO(g)+H2O(g) ΔH1=+41.3kJ/mol
第二步:2CO(g)+4H2(g)![]() C2H4(g)+2H2O(g) ΔH2=-210.5kJ/mol
C2H4(g)+2H2O(g) ΔH2=-210.5kJ/mol
CO2加氢合成乙烯的热化学方程式为__。
(2)利用CO2和H2合成甲醇又是一个有效利用CO2的途径,反应如下:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3
①在容积为2L的恒容密闭容器中,通入2molCO2和3molH2发生上述反应,下列说法能够表明该可逆反应达到平衡状态的是__(填字母)
a.消耗1.5molH2时,有0.5molCH3OH生成
b.转移3mol电子时,消耗11.2L(标准状况下)CO2
c.体系中气体的密度不变
d.水蒸气的体积分数保持不变
e.单位时间内生成H2与生成H2O的物质的量之比为3:1
②研究温度对该反应甲醇产率的影响。在210℃~290℃,保持原料气中CO2和H2的投料比不变,按一定流速发生上述反应。得到甲醇平衡产率与温度的关系如图所示,ΔH3__0(填“>”、“=”或“<”)。判断依据是__。
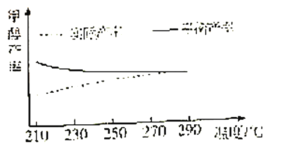
③在一固定容积的密闭容器中发生上述反应。若要提高平衡时CH3OH产率,则可以采取的措施是__(填字母)。
a.升温 b.加入催化剂 c.增加CO2的浓度 d.加入H2加压 e.加入惰性气体 f.分离出甲醇
(3)在一定温度和催化剂作用下,也可将CO2转化为燃料CH4,反应方程式为CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)。当30℃时,一定量的CO2和H2混合气体在容积为1L的恒容密闭容器中发生上述反应,5min后达到半衡,此时各物质的浓度如下表:
CH4(g)+2H2O(g)。当30℃时,一定量的CO2和H2混合气体在容积为1L的恒容密闭容器中发生上述反应,5min后达到半衡,此时各物质的浓度如下表:
物质 | CO2(g) | H2(g) | CH4(g) | H2O(g) |
浓度/mol·L-1 | 0.2 | 0. | a | 1.6 |
则a=__,该反应平衡常数K=__。
(4)以TiO2/Cu2Al2O4为催化剂,利用CH4可以将CO2直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图所示,乙酸的生成速率主要取决于温度影响的范围是__。250~300℃时,温度升高而乙酸的生成速率降低的原因是__。
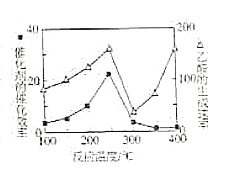
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备乙酸乙酯,乙酸正丁酯是中学化学实验中的两个重要有机实验
①乙酸乙酯的制备
②乙酸丁酯![]() 的制备
的制备
完成下列填空:
(1)制乙酸乙酯的化学方程式___________。
(2)制乙酸乙酯时,通常加入过量的乙醇,原因是________,加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是________;浓硫酸用量又不能过多,原因是_______________。
(3)试管②中的溶液是________,其作用是________________。
(4)制备乙酸丁酯的过程中,直玻璃管的作用是________,试管不与石棉网直接接触的原因是_____。
(5)在乙酸丁酯制备中,下列方法可提高1-丁醇的利用率的是________(填序号)。
A.使用催化剂 B.加过量乙酸 C.不断移去产物 D.缩短反应时间
(6)两种酯的提纯过程中都需用到的关键仪器是________,在操作时要充分振荡、静置,待液体分层后先将水溶液放出,最后将所制得的酯从该仪器的________(填序号)
A.上口倒出 B.下部流出 C.都可以
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com