
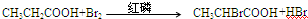 .
.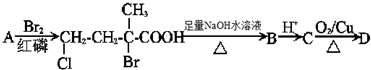
 .
.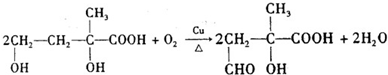 .
.分析 (1)根据题是信息在红磷存在时,丙酸可与液溴发生取代反应生成2-溴丙酸,据此写化学方程式;
(2)由A取代后的产物可知应为 ,
,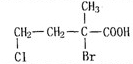 在NaOH溶液中发生水解生成B为
在NaOH溶液中发生水解生成B为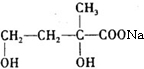 ,
, 与酸反应生成C为
与酸反应生成C为 ,
, 在Cu作催化剂条件下发生氧化反应生成D为
在Cu作催化剂条件下发生氧化反应生成D为 ,
,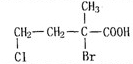 在NaOH的醇溶液中发生消去反应可生成E为
在NaOH的醇溶液中发生消去反应可生成E为 ,
, 与酸反应生成F为
与酸反应生成F为 ,据此答题.
,据此答题.
解答 解:(1)丙酸可与液溴发生取代反应生成2-溴丙酸(CH3CHBrCOOH),反应的化学方程式为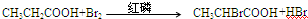 ,
,
故答案为: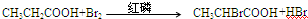 ;
;
(2)由A取代后的产物可知应为 ,
,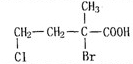 在NaOH溶液中发生水解生成B为
在NaOH溶液中发生水解生成B为 ,
, 与酸反应生成C为
与酸反应生成C为 ,
, 在Cu作催化剂条件下发生氧化反应生成D为
在Cu作催化剂条件下发生氧化反应生成D为 ,
,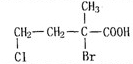 在NaOH的醇溶液中发生消去反应可生成E为
在NaOH的醇溶液中发生消去反应可生成E为 ,
, 与酸反应生成F为
与酸反应生成F为 ,
,
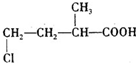
①由以上分析可知A为 ,故答案为:
,故答案为: ;
;
②D为 ,含有醛基、羟基和羧基,故答案为:含有醛基、羟基和羧基;
,含有醛基、羟基和羧基,故答案为:含有醛基、羟基和羧基;
③C为 ,在Cu作催化剂条件下发生氧化反应生成
,在Cu作催化剂条件下发生氧化反应生成 ,反应的方程式为
,反应的方程式为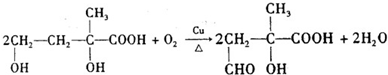 ,
,
故答案为: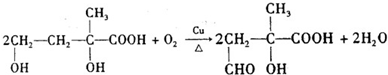 ;
;
④D为 ,含有-CHO,可发生银镜反应、加成反应、氧化反应和还原反应,含有-COOH,可发生酯化反应,含有-OH,邻位碳原子上含有H,可发生消去反应,不能发生水解反应,
,含有-CHO,可发生银镜反应、加成反应、氧化反应和还原反应,含有-COOH,可发生酯化反应,含有-OH,邻位碳原子上含有H,可发生消去反应,不能发生水解反应,
故答案为:A.
点评 本题考查有机物的推断,题目难度中等,注意根据有机物的官能团的性质和转化可用正推法推断有机物的种类,注意有机基础知识的灵活运用.


科目:高中化学 来源: 题型:选择题
| A. | a=b+m-n | B. | a=b-m+n | C. | a-m=b+n | D. | a-m=b-n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号、物理量 | M(Fe粉)/g | V[0.05mol.L-1Na2S2O8]/mL | V[H2O]/mL | 收集数据和得出结论 | |
| 1 | 100 | 0.3 | 50 | 50 | |
| 2 | 100V(污水)/mL | 0.3 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钠和金刚石 | B. | 晶体硅和水晶 | C. | 冰和干冰 | D. | 苯和四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数:C>d | B. | 离子还原性:Y>Z | C. | 稳定性:H2Y>HZ | D. | 原子半径:X<W |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
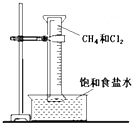 如图所示,用排饱和食盐水法先后收集20ml CH4和 80mlCl2,放在光亮的地方(注意:不要放在日光直射的地方,以免引起爆炸),等待片刻,观察发生的现象.回答下列问题:
如图所示,用排饱和食盐水法先后收集20ml CH4和 80mlCl2,放在光亮的地方(注意:不要放在日光直射的地方,以免引起爆炸),等待片刻,观察发生的现象.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
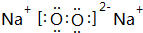 ,其化学键的类型为离子键、共价键.
,其化学键的类型为离子键、共价键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com