
【题目】有四种短周期元素,它们的结构、性质等信息如表所述:
元素 | 结构、性质等信息 |
X | 构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体 |
Y | 短周期中(除稀有气体外)原子半径最大的元素,该单质与冷水剧烈反应 |
Z | 与Y同周期,其最高价氧化物的水化物呈两性 |
M | 海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒剂和杀菌剂 |
请根据表中信息填写:
(1)X元素在周期表中的位置________;其相对分子质量最小的气态氢化物常用作______。
(2)工业上制取Y单质常用的方法是(用化学方程式表示)_________。
(3)Y离子半径比Z离子的半径________(填“大”或“小”)。
(4)Z的单质和氧化铁反应可用于野外焊接钢轨,该反应属于________(填“吸热”或“放热”)反应,写出反应的化学方程式为______________。
(5)举出实例说明M的非金属性比X强:_____________。
【答案】第2周期ⅣA族燃料2NaCl(熔融)![]() 2Na+Cl2↑大放热2Al+Fe2O3
2Na+Cl2↑大放热2Al+Fe2O3![]() Al2O3+2Fe稳定性:HCl>CH4或酸性燃料:HClO4>H2CO3(两者答其中一个即可,其他合理答案也可)
Al2O3+2Fe稳定性:HCl>CH4或酸性燃料:HClO4>H2CO3(两者答其中一个即可,其他合理答案也可)
【解析】
X元素是构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体,故X为碳元素;Y是短周期中(除稀有气体外)原子半径最大的元素,该单质液态时可用作核反应堆的传热介质,故Y为Na;Z与Y同周期,其最高价氧化物的水化物呈两性,则Z为Al;M是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,故M为Cl。
构成有机物的核心元素为C元素,短周期中原子半径最大的是Na元素,与钠同周期且最高价氧化物的水化物呈两性的是Al元素,自来水生产过程中常用的消毒剂和杀菌剂是Cl2。(1)碳的氢化物中相对分子质量最小的是甲烷,甲烷常用作燃料。(2)金属钠是活泼金属,常用电解法冶炼,2NaCl(熔融)![]() 2Na+Cl2↑ 。(3)Na+和Al3+具有相同的电子数,但核电荷数Al>Na,故离子半径Na+>Al3+。(4)铝与氧化铁在高温下发生铝热反应,生成铁单质,用于焊接钢轨。方程式为2Al+Fe2O3
2Na+Cl2↑ 。(3)Na+和Al3+具有相同的电子数,但核电荷数Al>Na,故离子半径Na+>Al3+。(4)铝与氧化铁在高温下发生铝热反应,生成铁单质,用于焊接钢轨。方程式为2Al+Fe2O3![]() Al2O3+2Fe ;(5)比较元素非金属性强弱的依据有:比较单质与氢气化合的难易程度,生成氢化物的稳定性,最高价含氧酸的酸性等。
Al2O3+2Fe ;(5)比较元素非金属性强弱的依据有:比较单质与氢气化合的难易程度,生成氢化物的稳定性,最高价含氧酸的酸性等。


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】C60、金刚石、石墨、二氧化碳和氯化铯的结构模型如图所示(石墨仅表示出其中的一层结构):
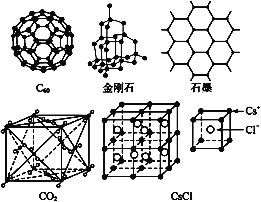
(1)C60、金刚石和石墨三者的关系是互为____。
A.同分异构体 B.同素异形体 C.同系物 D.同位素
(2)固态时,C60属于____(填“原子”或“分子”)晶体,C60分子中含有双键的数目是____。
(3)晶体硅的结构跟金刚石相似,1 mol晶体硅中含有硅—硅单键的数目约是____NA。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是____。
(5)观察CO2分子晶体结构的一部分,试说明每个CO2分子周围有____个与之紧邻且等距的CO2分子;该结构单元平均占有____个CO2分子。
(6)观察图形推测,CsCl晶体中两距离最近的Cs+间距离为a,则每个Cs+周围与其距离为a的Cs+数目为___,每个Cs+周围距离相等且次近的Cs+数目为___,距离为___,每个Cs+周围距离相等且第三近的Cs+数目为____,距离为____,每个Cs+周围紧邻且等距的Cl-数目为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用合成气(CO和H2)制取乙醇的反应为2CO+4H2![]() CH3CH2OH+H2O。研究发现,使用TiO2作为载体负载铑基催化剂具有较高的乙醇产量。回答下列问题:
CH3CH2OH+H2O。研究发现,使用TiO2作为载体负载铑基催化剂具有较高的乙醇产量。回答下列问题:
(1)Ti基态原子核外电子排布式为_________。和O同一周期且元素的第一电离能比O大的有______(填元素符号),和O同一周期且基态原子核外未成对电子数比O多的有____(填元素符号)。
(2)H2O分子中O原子的价层电子对数是________,CH3CH2OH分子中亚甲基(-CH2-)上的C原子的杂化形式为_______。
(3)在用合成气制取乙醇反应所涉及的4种物质中,沸点从低到高的顺序为_________,原因是__________。
(4)工业上以CO、O2、NH3为原料,可合成氮肥尿素[CO(NH2)2],CO(NH2)2分子中含有的σ键与π键的数目之比为_________。
(5)C元素与N元素形成的某种晶体的晶胞如图所示(8个碳原子位于立方体的顶点,4个碳原子位于立方体的面心,4个氮原子在立方体内),该晶体硬度超过金刚石,成为首屈一指的超硬新材料。
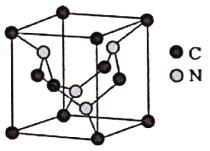
①该晶体硬度超过金刚石的原因是____________。
②已知该晶胞的密度为d g/cm3,N原子的半径为r1cm,C原子的半径为r2cm,设NA为阿伏加德罗常数,则该晶胞的空间利用率为________(用含d、r1、r2、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化石墨烯具有优良的生物亲和性和亲水性,可通过下列实验方法制得(装置如图所示):
①低温阶段:控温0℃,烧瓶中加入3g石墨烯、12 g KMnO4和100 mL浓硫酸,搅拌反应20 min;
②中温阶段:水浴控温15℃,反应2 h;再控湿35℃,反应40 min;
③高温阶段:用220 mL高纯水稀释反应液,控温80℃,反应20 min,再滴入10 mL 30%H2O2溶液,控温45℃,待胶体变为金黄色,静置24 h;倾出上层清液,用盐酸洗涤下层沉淀,过滤、高纯水洗涤、真空干燥,得到氧化石墨烯。
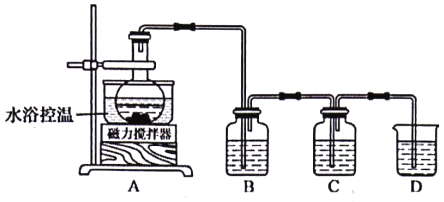
回答下列问题:
(1)将石墨中的层状结构剥离就能得到石墨烯,石墨烯的化学成分是_______(写名称)。
(2)“低温阶段”控温0℃的方法是____________。
(3)装置B装入酸性KMnO4溶液,其目的是_________;装置C用于检测CO2的生成,则判断有CO2生成的实验现象是_______________。
(4)“高温阶段”中,控温80℃之前,必须加入高纯水稀释反应液,稀释的操作方法是_______。“高温阶段”若温度过高,反应液极易发生“暴沸”而导致实验失败,其原因是__________。
(5)“高温阶段”滴入10 mL 30% H2O2溶液的目的是为了除去过量的KMnO4,反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/(mol) | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)达到平衡的时间是________,理由是___________________。
(2)如图中表示NO2的浓度变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内各物质的浓度保持不变
c.v逆(NO)=2v正(O2)
d.达到化学平衡时,NO将完全转化为NO2
(4)能增大该反应的反应速率的是________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的氧化物对环境的影响较大,CO是燃煤工业生产中的大气污染物,CO2则促进了地球的温室效应。给地球生命带来了极大的威胁。
(1)已知:①甲醇的燃烧热△H=-726.4kJ·mol-1
②H2(g)+ ![]() O2(g)=H2O(l) △H=-285.8kJ·mol-1。
O2(g)=H2O(l) △H=-285.8kJ·mol-1。
则二氧化碳和氢气合成液态甲醇,生成液态水的热化学方程式为_____________________________。
(2)二氧化碳合成CH3OH 的热化学方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1,过程中会产生副反应:CO2(g)+H2(g)
CH3OH(g)+H2O(g)△H1,过程中会产生副反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H2。图1是合成甲醇反应中温度对CH3OH、CO的产率影响曲线图,△H2________0(填“>”或“<”)。增大反应体系的压强,合成甲醇的反应速率___________(填“增大”“减小”或“ 不变”),副反应的化学平衡________(填“向正反应方向”“向逆反应方向”或“不”)移动。
CO(g)+H2O(g)△H2。图1是合成甲醇反应中温度对CH3OH、CO的产率影响曲线图,△H2________0(填“>”或“<”)。增大反应体系的压强,合成甲醇的反应速率___________(填“增大”“减小”或“ 不变”),副反应的化学平衡________(填“向正反应方向”“向逆反应方向”或“不”)移动。
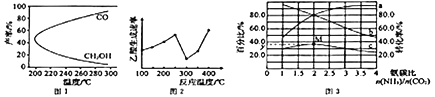
(3)以某些过渡金属氧化物作催化剂,二氧化碳与甲烷可转化为乙酸:CO2(g) +CH4(g)![]() CH3COOH(g) △H=+36.0kJ·mol-1。不同温度下,乙酸的生成速率变化曲线如图2。结合反应速率,使用催化剂的最佳温度是________℃,欲提高CH4的转化率,请提供一种可行的措施:____________________________。
CH3COOH(g) △H=+36.0kJ·mol-1。不同温度下,乙酸的生成速率变化曲线如图2。结合反应速率,使用催化剂的最佳温度是________℃,欲提高CH4的转化率,请提供一种可行的措施:____________________________。
(4)一定条件下,CO2 与NH3 可合成尿素[CO(NH2)2]:CO2(g)+2NH3(g)![]() CO(NH2)2(g)+H2O(g)△H。某温度下。在容积为1L的恒容密闭容器中,加入一定氨碳比
CO(NH2)2(g)+H2O(g)△H。某温度下。在容积为1L的恒容密闭容器中,加入一定氨碳比![]() 的3molCO2 和NH3的混合气体。图3是有关量的变化曲线,其中表示NH3转化率的是曲线________(填“a”或“b”),曲线c 表示尿素在平衡体系中的体积分数变化曲线,则M点的平衡常数K=________,y=________。
的3molCO2 和NH3的混合气体。图3是有关量的变化曲线,其中表示NH3转化率的是曲线________(填“a”或“b”),曲线c 表示尿素在平衡体系中的体积分数变化曲线,则M点的平衡常数K=________,y=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在一定温度下将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)=- 2C(g)+ 2D(g),2 分钟末反应达到平衡状态,生成了0.6mol D,回答下列问题:
(1)用D表示2min内的平均反应速率为____________,A的转化率为_____________。
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度_________(填“增大”、“减少”或“不变”)。
(3)若开始时只加C和D各4/3mol,要使平衡时各物质的质量分数与原平衡相等,则还应加入_____________mol B 物质。
(4)若向原平衡体系中再投入1molA和1molB,B的转化率_________(填“增大”、“减少”或“不变”)。
II.有人设计出利用CH3OH 和O2的反应,用铂电极在KOH 溶液中构成原电池。电池的总反应类似于CH3OH 在O2中燃烧,则:
(1)每消耗1molCH3OH 可以向外电路提供___________mole-;
(2)负极电极反应式为________________________。
(3)电池放电后,溶液的pH_________(填“增大”、“减少”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com