
一定温度下,可逆反应2NO2(g)
 2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是( )
2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2,同时生成2n mol NO2
②单位时间内生成n mol O2,同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均相对分子质量不再改变
A.①④⑤⑥ B.①②③⑤ C.②③④⑥ D.以上全部
A [①生成n mol O2,就是消耗2n mol NO2,即生成NO2的速率等于消耗NO2的速率,能表示v正=v逆,正确。②表示同一方向的反应速率,不能表示v正=v逆,不正确。③只要发生反应,或者说不论反应是否达到平衡,NO2、NO、O2的反应速率之比均为2∶2∶1,它不能反映可逆反应是否达到平衡,不正确。④温度、体积一定,混合气体压强不再改变,对于反应前后气体体积不相等的反应,说明气体的总物质的量不再改变,表明已达平衡。⑤颜色的深浅决定于有色物质NO2的浓度,混合气体颜色不变,说明NO2的浓度不再改变,能说明已达到平衡,正确。⑥混合气体的平均相对分子质量( =
=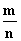 )不变,说明气体的总物质的量(n)不变,表明已达平衡,正确。
)不变,说明气体的总物质的量(n)不变,表明已达平衡,正确。
方法点击 判断可逆反应是否达到化学平衡状态的依据和方法
可逆反应达到化学平衡状态时有两个主要的特征:一是正反应速率和逆反应速率相等;二是反应混合物中各组成的质量(或浓度)保持不变。这两个特征就是判断可逆反应是否达到化学平衡状态的核心性依据。可逆反应具备这两个特点之一,它就达到了化学平衡状态,可逆反应不具备这两个特征中的任何一个,它就未达到化学平衡状态。]


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+===Fe3++Ce3+
Sn2++2Fe3+===2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )
A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ce3+
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物L的分子式为C3H6O2,水解后得到饱和一元酸M和饱和一元醇N,已知M和N的相对分子质量相同,则下列叙述中不正确的是( )
A.M具有还原性 B.M中没有甲基
C.M不能发生银镜反应 D.L具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组为探究铜与浓硫酸的反应,用下图所示装置进行有关实验。甲同学取ag铜片和12 mL 18 mol·L-1浓硫酸放入圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余。
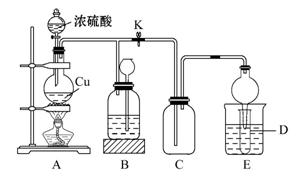
(1)Cu与浓硫酸反应的化学方程式是___________________________。
装置E中试管D内盛有品红溶液,当C中气体集满后,D中有可能观察到的现象是__________________________________,为避免实验装置D有可能造成的环境污染,可用浸有NaOH溶液的棉花团塞在试管口,其反应原理是_________(用离子方程式表示)。
(2)装置B的作用是贮存多余的气体,B中应放置的液体是______(填序号)。
a.饱和Na2SO3溶液 b.酸性KMnO4溶液
c.浓溴水 d.饱和NaHSO3溶液
当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是_________________________________________。
(3)反应完毕后,烧瓶中还有一定量的余酸,却不能使Cu完全溶解的原因是
____________________________;使用足量的下列药品不能用来证明反应结束后的烧瓶中的确有余酸的是______(填序号)。
a.铁粉 b.BaCl2溶液
c.CuO d.Na2CO3溶液
实验中某学生向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,该反应的化学方程式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,反应A2(g)+B2(g)
 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )
A.单位时间内生成n mol的A2,同时生成n mol的AB
B.容器内的总压强不随时间的变化而变化
C.单位时间内生成2n mol的AB同时生成n mol的B2
D.平均相对分子质量不随时间变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )
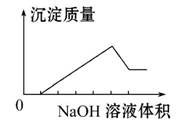
A.Mg2+、Al3+、Fe2+ B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+ D.只有Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇是日常生活中最常见的有机物之一,乙醇的一种工业制法如下:乙烯+A―→CH3CH2OH
请回答下列问题:
(1)已知该反应中原子利用率为100%,符合绿色化学思想,则反应物A的化学式为________。
(2)B是上述反应的重要产物,按如下关系转化:B C
C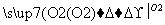 D
D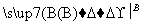 E,E是B与D发生取代反应的产物,则B→C,D→E的反应方程式为_____________________________________
E,E是B与D发生取代反应的产物,则B→C,D→E的反应方程式为_____________________________________
___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图转化关系(Ph—表示苯基C6H5—):
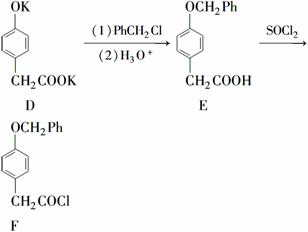
E有多种同分异构体,写出符合下列条件的E的两种同分异构体的结构简式____________。
①分子中含有2个苯环且每个苯环上都有2个互为对位的取代基。
②能发生水解反应,且水解产物都能与FeCl3溶液发生显色反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电池的说法不正确的是( )
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.甲醇燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com