
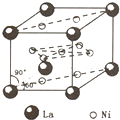
 氢是新型清洁能源,但难储运,研究发现,合金可用来储藏氢气,镧(
氢是新型清洁能源,但难储运,研究发现,合金可用来储藏氢气,镧(139 57 |
59 28 |
| 1 |
| 2 |
| 1 |
| 8 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、Mg2+、K+、Cl-、NO3- |
| B、H+、K+、HCO3-、NO3- |
| C、Cu2+、NO3-、SO42-、Cl- |
| D、OH-、Cl-、Na+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
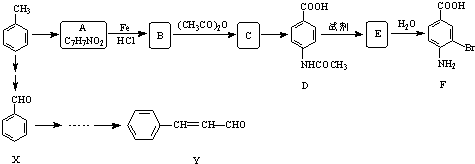
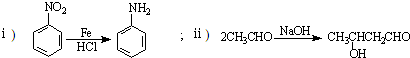
| O2 |
| 催化剂 |
| CH3CH2OH |
| 浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
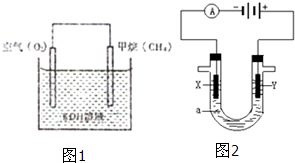 在海底和青藏高原都发现了名为“可燃冰”的环保型新能源,主要成分是CH4,CH4在光照下可与Cl2反应,也可以用CH4和H2O为原料制备二甲醚和甲醇等新型燃料.
在海底和青藏高原都发现了名为“可燃冰”的环保型新能源,主要成分是CH4,CH4在光照下可与Cl2反应,也可以用CH4和H2O为原料制备二甲醚和甲醇等新型燃料.查看答案和解析>>
科目:高中化学 来源: 题型:
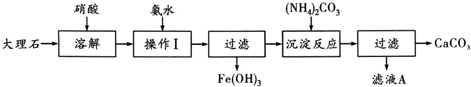
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.1g | B、3.6g |
| C、7.2g | D、不可求 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑥⑧ | B、②⑤⑦⑧ |
| C、②⑤⑥⑦ | D、②④⑤⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com