
【题目】下列离子方程式书写正确的是( )
A.标准状况下2.24LCO2通入1molL-1100![]() 氢氧化钠溶液中:CO2+OH-=HCO3-
氢氧化钠溶液中:CO2+OH-=HCO3-
B.硝酸铝溶液中加入过量氨水Al3++4NH3·H2O=AlO2-+4NH4++2H2O
C.Na2S水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
D.等物质的量的NH4HCO3与NaOH在溶液中反应:NH4++HCO3-+2OH-=CO32-+NH3↑+2H2O
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】绚烂多彩的物质世界都是由各种元素组成的。请在氧、碳、氢、钠这4种元素中选择适当的元素,按要求用化学用语填空(每空只要求写一个):(1)最轻的气体是 ;(2)因与人体血红蛋白结合而使人中毒的物质 ;(3)白酒、啤酒、红酒等酒精类饮料中的主要溶质 ;(4)实验室制备氧气的反应原理(用化学方程式表示) 。
(5)农村的情洁能源沼气燃烧的化学方程式 ;
(6)生成物能使澄清石灰水变浑浊的化合反应 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D代表原子序数依次增大的四种短周期非金属元素,它们满足以下条件:
①C的原子序数是A、B的原子序数之和,A、C、D的最外层电子数和为13; ②D的原子序数是C的2倍,D的最高价氧化物对应的水化物是二元强酸。
试根据以上叙述回答:
(1)B单质的结构式为________,画出C元素的原子结构示意图________________;
(2)下列环境问题与B与C形成的化合物有关的是________;
A.温室效应 B.光化学烟雾 C.酸雨 D.PM2.5
II.现有下列短周期元素相关性质的数据:
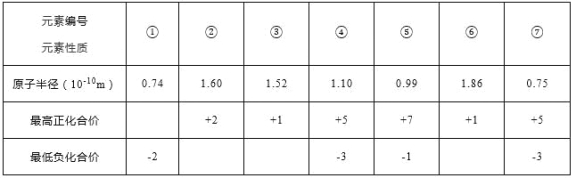
试回答下列问题:
(l)元素⑤在周期表中韵位置__________________;
(2)元素④与元素⑦相比较,气态氢化物较稳定的是_____________(填结构式);
(3)元素④形成的+3和+5价的氯化物中,各原予均达到8电子稳定结构的化合物是___________(写化学式);
(4)以下叙述正确的是____________。
A.氢化物的沸点为④<⑦
B.①与②形成的化合物具有两性
C.与稀盐酸反应单质②比单质⑥快
D.最高价氧化物对应水化物的碱性③>⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸在下列反应中,只起催化作用的是( )
①乙酸和乙醇的酯化反应
②苯的硝化反应
③油脂的水解反应
④淀粉的水解反应
A. ①④
B. ②④
C. ③④
D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.
请回答下列问题:
(1)阳离子交换膜把电解槽隔成了阴极室和阳极室,电解食盐水时,它只允许 (填离子符号)通过。
(2)为了去除粗盐中混有的Ca2+、Mg2+、SO42-.下列选项中所加试剂(均为溶液)及加入顺序均合理的是 (填选项字母)
A.先加足量的BaCl2,再加足量的Na2CO3,最后加入适量稀盐酸
B.先加入足量的NaOH.再加入足量的BaCl2,然后加入足量Na2CO3,最后加入适量稀盐酸
C.先加足量的Na2CO3,再加足量的BaCl2,然后加足量的NaOH,最后加入适量稀盐酸.
D.先加足量的Ba(NO3)2,再加足量NaOH,然后再加足量的Na2CO3,最后加入适量稀盐酸.
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过.

图中X、Y分别是 、 (填化学式),分析比较图示中氢氧化钠质量分数 a、b、c的从大到小的顺序为
分别写出燃料电池中正极、负极上发生的电极反应正极: ;负极: ;
这样设计的主要节(电)能之处在于(任写出一条)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 因为液态氨气化时吸热,可用液态氨作制冷剂
B. 用铝制容器盛放浓硝酸,是因为铝和浓硝酸不反应
C. 明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用
D. 铝能置换出氧化铁中的铁,钢铁工业利用铝热反应冶炼铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2![]() 2NH3。该可逆反应达到平衡的标志是________________。
2NH3。该可逆反应达到平衡的标志是________________。
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
E.a molN≡N键断裂的同时,有6amolN—H键断裂
F.N2、H2、NH3的分子数之比为1∶3∶2
(2)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25min时,以N2表示的平均反应速率= ;该温度下平衡常数K= ;
(3) 利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H=-99kJ·mol-1
CH3OH(g) △H=-99kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H
CO(g)+H2O(g) △H
图1中能正确反映平衡常数K随温度变化关系的曲线是 ;反应③的△H= kJ·mol-1。
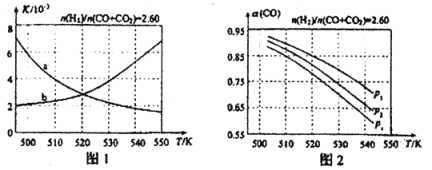
(4)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率α(CO)与温度和压强的关系如图2所示。图中的压强p1、p2、p3由大到小的顺序为 ;α(CO)随温度升高而减小,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将甲针筒内的物质压到乙针筒内,进行实验,对乙针筒里的现象所作的判断不正确的是( )
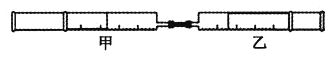
实验序号 | 甲针筒内物质 | 乙针筒内物质 | 乙针筒里的现象 |
A | HCl | AgNO3溶液 | 产生白色沉淀 |
B | NH3 | FeCl3溶液 | 出现红褐色沉淀 |
C | SO2 | BaCl2 | 产生白色沉淀 |
D | Cl2 | 紫色石蕊溶液 | 先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO2+2Na2O2=2Na2CO3+O2,在密闭容器中,将6.6gCO2与一定量的Na2O2固体充分反应后,气体变为3.8g。下列说法正确的是()
A.3.8g气体全部是O2
B.3.8g气体通过足量NaOH溶液后,气体减少2.2g
C.反应后的固体是混合物
D.生成Na2CO3的质量为15.9g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com