
【题目】在一定条件下,Na2CO3溶液中存在CO+H2O![]() HCO+OH-平衡。下列说法不正确的是( )
HCO+OH-平衡。下列说法不正确的是( )
A.稀释溶液,增大
B.加入NaOH固体, 减小
C.升高温度,平衡常数增大
D.通入CO2,溶液pH减小
科目:高中化学 来源: 题型:
【题目】有机合成在制药工业上有着极其重要的地位。现用硝基苯制取苯胺,再用苯胺制得无 色晶体乙酰苯胺(具有退热镇痛作用的药物)。
①化学反应原理为:
![]()
②相关物质的物理常数
物质 | 相对分子质量 | 熔点(℃) | 沸点(℃) | 溶解度(g) | |
水 | 乙醇 | ||||
苯胺 | 93 | -6 | 184 | 3.42(20℃) | 任意比混溶 |
乙酸 | 60 | 17 | 117.9 | 任意比混溶 | 任意比混溶 |
乙酰苯胺 | 135 | 114 | 304 | 0.56(20℃) 3.45(50℃) 5.20(100℃) | 36.9(20℃) |
③制备乙酰苯胺的装置及过程如下图所示:
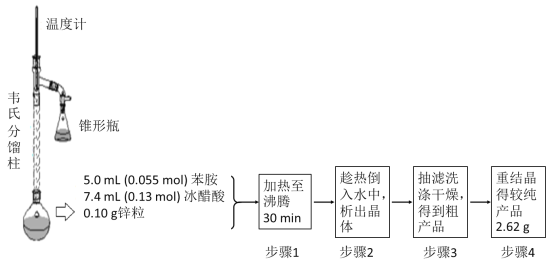
已知:Ⅰ苯胺易被氧化;Ⅱ韦氏分馏柱作用与原理类似于冷凝管
请回答以下问题:
(1)加入锌粒的目的是___________;韦氏分馏柱作用的是_________;
(2)步骤1中保持柱顶温度约为105℃,则锥形瓶中收集到的馏分主要是_____________;
(3)步骤2中将反应液倒入水中的目的是___________;
(4)步骤3中洗涤剂最好选择______________;
A.冷水 B.热水 C.15%的乙醇溶液 D.NaOH溶液
(5)步骤4重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→________→__________→抽滤→洗涤→干燥;
(6)上述制备过程的产率是____________。(结果保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶澄清溶液,其中可能含有NH、K+、Ba2+、Al3+、Fe3+、I-、NO、CO、SO、AlO。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性;
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色;
③另取溶液适量,逐滴加入NaOH溶液;
a.溶液从酸性变为中性;b.溶液逐渐产生沉淀;c.沉淀完全溶解;d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝;
④取适量③得到的碱性溶液,加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题。
(1)由①可以排除________________________的存在。
(2)由②可以证明________的存在;同时排除 的存在。
(3)由③可以证明_____________的存在;写出c、d所涉及的化学方程式,是离子反应的用离子方程式表示:c________________;d________________。
(4)由④可以排除________的存在。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量的氧化铁杂质。具体实验流程如下:
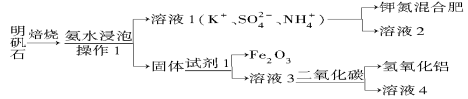
(1)操作1所用到的玻璃仪器的名称是 。
(2)由溶液3制取氢氧化铝的离子方程式为 。
(3)明矾石焙烧时产生SO2,请你写出能验证SO2具有还原性且实验现象明显的化学方程式: 。
(4)请你写出验证溶液1中有NH4+的实验过程: 。
(5)实验室用Fe2O3与CO反应来制取单质Fe。
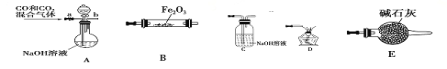
①请按气流由左到右的方向连接下列各装置,顺序为A→________。
②在点燃B处的酒精灯前,应进行的操作是____________。
③装置C的作用是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.5 g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶于水,制成稀溶液,然后向该溶液中逐滴加入1 mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(1) 写出OA段所发生反应的离子方程式_______________。
(2)当加入35 mL盐酸时,产生CO2的体积为___________mL(标准状况)。
(3)原混合物中NaOH的质量为___________g,碳酸钠的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示。下列说法中不正确的是( )

A.T ℃时,在Y点和Z点,Ag2CrO4的Ksp相等
B.向饱和Ag2CrO4溶液中加入固体K2CrO4不能使溶液由Y点变为X点
C.T ℃时,Ag2CrO4的Ksp为1×10-8
D.图中a=×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关SO2和CO2的说法正确的是
A.都是非极性分子
B.中心原子都采取sp杂化
C.S原子和C原子都没有孤对电子
D.SO2为V形结构,CO2为直线形结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是:
2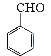 +KOH
+KOH![]()
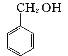 +
+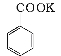 ;
; +HCl
+HCl![]()
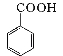 +KCl
+KCl
制备苯甲醇和苯甲酸的主要过程如下:
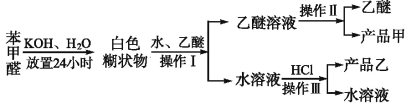
已知:苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,溶解度为0.34 g;乙醚的沸点为34.8 ℃,难溶于水。
试根据上述信息回答下列问题:
(1)操作Ⅰ的名称是 ;
乙醚溶液中所溶解的主要成分是 (写名称,下同)。
(2)操作Ⅲ的名称是 ;产品乙是 。
(3)现有下图所示的四种装置,进行操作Ⅱ应选择的最合理装置是 (填序号);
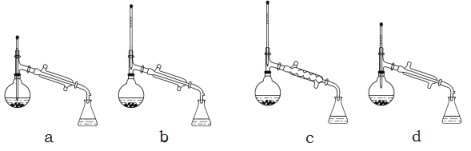
操作中还需要用到的的玻璃仪器是 ;得到的产品甲是在 中(写仪器名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)苯、四氯化碳、乙醇、汽油是常见的有机溶剂,能与水互溶的是 ,不溶于水,且密度比水小的是 。
(2)写出下列反应的化学方程式并注明反应类型
① 用乙烷制备氯乙烷(C2H5Cl) , ;
② 乙烯与水反应制乙醇 , ;
③ 苯制取溴苯 , 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com