
【题目】固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用下图装置(夹持装置略)对其进行探究实验。
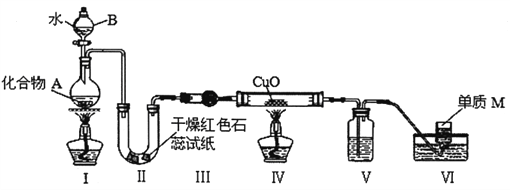
(1)仪器A的名称是________,仪器B在该实验中有两个作用:一是控制反应速度,二是_______________________。
(2)试验中,II中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有M生成。
①Ⅲ中的试剂为________________;
②Ⅳ发生反应的化学方程式为_____________________________;
③V的作用为_______________;装置V的缺陷是___________________.
(3)乙组同学进行同样实验,但装置连接顺序为I-Ⅲ一Ⅳ- II-V-Ⅵ,此时II中现象为__________,
原因是_______________________。
(4)化合物A中含单质M的元素的质量分数为28%,则A的化学式为____________,写出A与水反应的化学方程式:__________________________________________。
【答案】 圆底烧瓶 加注液态反应物 碱石灰 3CuO+2NH3![]() 3Cu+N2+3H2O 除去没有被氧化完的氨气 没有防倒吸 试纸变蓝 CuO与氨气反应生成的水和未反应的氨气形成氨水,呈碱性,使试纸变蓝 Mg3N2 Mg3N2+6H2O=3Mg(OH)2+2NH3↑
3Cu+N2+3H2O 除去没有被氧化完的氨气 没有防倒吸 试纸变蓝 CuO与氨气反应生成的水和未反应的氨气形成氨水,呈碱性,使试纸变蓝 Mg3N2 Mg3N2+6H2O=3Mg(OH)2+2NH3↑
【解析】(1)仪器A的名称是圆底烧瓶。仪器B是分液漏斗,在该实验中有两个作用:一是控制反应速度,二是加注液态反应物。
(2)试验中,II中的干燥的红色石蕊试纸变蓝,说明I中可以生成潮湿的氨气;氨气经碱石灰干燥后通入IV中,Ⅳ中黑色粉末逐渐变为红色,说明氧化铜被还原为铜,同时有单质M生成,由VI知,M不溶于水,所以M是氮气,氨气被氧化为氮气。
①氨气常用碱石灰干燥,所以Ⅲ中的试剂为碱石灰;
②Ⅳ发生反应的化学方程式为3CuO+2NH3![]() 3Cu+N2+3H2O;
3Cu+N2+3H2O;
③V的作用为除去没有被氧化完的氨气;装置V的缺陷是不能防倒吸。
(3)乙组同学进行同样实验,但装置连接顺序为I-Ⅲ一Ⅳ- II-V-Ⅵ,此时II中现象为试纸变蓝,原因是CuO与氨气反应生成的水和未反应的氨气形成氨水呈碱性,使试纸变蓝。
(4)由题意知,固态化合物A由两种短周期元素组成,可与水发生复分解反应生成氨气,所以化合物A中氮元素的化合价为-3,则另一种元素应为金属(设为R)。化合物A中氮元素的质量分数为28%,若金属R化合价为+1,则A为R3N,求出R的相对原子质量为12,不合理;若金属R化合价为+2,则A为R3N2,求出R的相对原子质量为24,是镁,合理,所以A的化学式为Mg3N2,A与水反应的化学方程式Mg3N2+6H2O=3Mg(OH)2+2NH3↑。


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
【题目】我们穿的衣服通常是由纤维织成的,常见的纤维有棉花、羊毛、涤纶等。用灼烧法可初步鉴别三种纤维,给三种纤维编号后,分别灼烧产生的气味如下:
纤维编号 | ① | ② | ③ |
灼烧时的气味 | 特殊气味 | 烧纸气味 | 烧焦羽毛气味 |
则羊毛的编号为_________,棉花的编号为_________,涤纶的编号为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质A在一定条件下加热完全分解,产物都是气体。分解方程式为 4A=B+2C+2D,测得生成的混合气体对氢气的相对密度为2 d,则A的相对分子质量为( )
A. 7d B. 5d C. 2.5d D. 2d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源。
(1)101 kPa时,1 mol CH3OH液体完全燃烧生成CO2和液态水时放出热量726.51 kJ,则表示甲醇燃烧的热化学方程式为_______________________________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1=+49.0 kJ·mol-1 ②CH3OH(g)+ ![]() O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2
已知H2(g)+ ![]() O2(g)===H2O(g) △H = —241.8kJ·mol-1,则反应②的△H2=_____________。
O2(g)===H2O(g) △H = —241.8kJ·mol-1,则反应②的△H2=_____________。
(3)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)![]() CH3OH(g),现在实验室模拟该反应并进行分析。下图是该反应在不同温度下CO的转化率随时间变化的曲线如右图。
CH3OH(g),现在实验室模拟该反应并进行分析。下图是该反应在不同温度下CO的转化率随时间变化的曲线如右图。

①该反应的焓变ΔH______0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______K2(填“>”、“<”或“=”)。
(4)H2 和CO合成甲醇反应为:CO(g)+2H2(g)![]() CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则达到平衡时CO的浓度为_______;10min内用H2表示的化学反应速率为_______;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有________________(填一种合理的措施)。
CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则达到平衡时CO的浓度为_______;10min内用H2表示的化学反应速率为_______;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有________________(填一种合理的措施)。
(5) 二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为: CO2(g) +3H2(g) ![]() CH3OH(g) +H2O(g) △H 。
CH3OH(g) +H2O(g) △H 。
①该反应的平衡常数表达式为K=___________。
②在恒容密闭容器中使CO2和H2(物质的量之比为1∶3)发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如下图所示,则△H _________0(填“大于”或“小于”)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 制作印刷电路板: Fe3++ Cu = Fe2++ Cu2+
B. Ca(HCO3)2溶液中加足量NaOH溶液:HCO3-+ Ca2++ OH-= CaCO3↓ + H2O
C. 用NaOH溶液吸收Cl2: Cl2+ 2OH-= Cl-+ ClO3-+ H2O
D. 明矾常用于净水:Al3++ 3H2O![]() Al(OH)3(胶体)+ 3H+
Al(OH)3(胶体)+ 3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法,错误的是
A.元素周期表是元素按原子序数大小排列而成的
B.元素原子的电子层数等于其所在周期的周期序数
C.元素原子的最外层电子数等于其所在族的族序数
D.元素周期表是元素周期律的具体表现形式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com