
【题目】[Cu(NH3)4]SO4是一种深蓝色的配位化合物。
(1)Cu2+可被还原成Cu+,Cu+基态核外的外围电子排布式为_________________________。
(2)H元素与N元素可形成分子式为N2H2的化合物,该物质的分子具有平面结构,则该分子中N原子的杂化轨道类型为______________________。
(3)与CS2分子互为等电子体的SCN-离子的电子式为_________________。
(4)Cu可形成多种配合物,且各种配合物有广乏的用途。某Cu的配合物结构如图1所示,则该配合物中心原子Cu的配体数为____;其分子内含有的作用力有________(填序号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位健
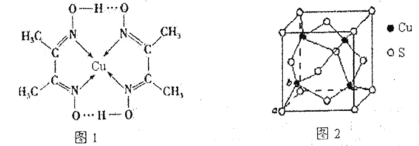
(5)Cu元素与S元素形成的一种化合物品跑如图2所示,其中S的配位数为______________。
【答案】3d10 sp2 ![]() 2 ACE 4
2 ACE 4
【解析】
(1)Cu+基态核外3d能级上10个电子为其价电子;
(2)H元素与N元素可形成分子式为N2H2的化合物,该物质的分子具有平面结构,其结构式为H-N=N-H,该分子中N价层电子对个数是3且含有一个孤电子对,根据价层电子对互斥理论判断N原子杂化类型;
(3)等电子体结构相似,与CS2分子互为等电子体的SCN-离子结构中S和N都分别与C原子形成双键;
(4)某Cu的配合物结构如下图1所示,则该配合物中心原子Cu的配体数为2,其分子内碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间为氢键;
(5)根据图知,每个S原子连接4个Cu原子。
(1)Cu为29号元素,其核外电子排布为1s22s22p63s23p63d104s1,失去一个电子得到Cu+;Cu+基态核外3d能级上10个电子为其价电子,其价电子排布式为3d10;
(2)H元素与N元素可形成分子式为N2H2的化合物,该物质的分子具有平面结构,其结构式为H-N=N-H,该分子中N价层电子对个数![]() ,含有一个孤电子对,N原子杂化类型为sp2;
,含有一个孤电子对,N原子杂化类型为sp2;
(3)等电子体结构相似,CS2中S和C之间形成双键,则与CS2分子互为等电子体的SCN-离子结构中S和N都分别与C原子形成双键,其结构式为![]() ;
;
(4)从图1可知,则该配合物中心原子Cu的配体数为2,其分子内碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间为氢键,所以存在氢键、配位键和共价键,答案为ACE;
(5)根据图知,以上底面面心上S原子为例,该S原子连接该晶胞中2个Cu原子,还连接该晶胞上面晶胞中2个Cu原子,所以每个S原子连接4个Cu原子,即其配位数是4。


科目:高中化学 来源: 题型:
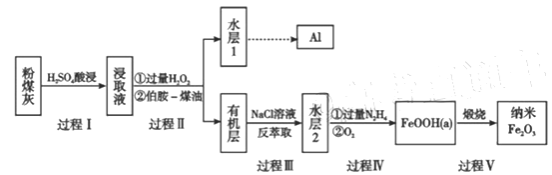
【题目】粉煤灰是燃煤产生的重要污染物,主要成分有Al2O3、Fe2O3、Fe3O4和SiO2等物质。综合利用粉煤灰不仅能够防止环境污染,还能获得纳米Fe2O3等重要物质。
已知:
i)伯胺R-NH2能与Fe3+反应;3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
ii)Fe3+在水溶液中能与Cl-反应:Fe3++6Cl-![]() [FeCl6]3-,回答下列问题:
[FeCl6]3-,回答下列问题:
(1)过程I对煤粉灰进行酸浸过滤后,滤渣的主要成分是_________。
(2)写出过程II加入过量H2O2发生的离子方程式_________。加入伯胺-煤油对浸取液进行分离,该操作的名称是_________。
(3)从化学平衡角度解释过程III利用NaCl溶液进行反萃取的原理________。
(4)过程IV中过量的N2H4将水层2中[FeCl6]3-转化为Fe2+,得到的Fe2+再被O2氧化为FeOOH,其中第一步的离子方程式为4[FeCl6]3-+5N2H4=4Fe2++N2+.4N2H5++24Cl-,该反应中氧化剂与还原剂的物质的量之比为_________。
(5)在常压用纳米Fe2O3电化学法合成氨的装置如图所示。
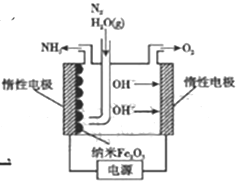
已知电解液为熔融NaOH-KOH,纳米Fe2O3在阴极发生电极反应分两步进行:该电解池第二步:2Fe+N2+3H2O=Fe2O3+2NH3。则该电解池第一步发生反应的方程式为_________。纳米Fe2O3在电解过程中所起的作用是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命名法写出下列物质名称或结构简式:
(1)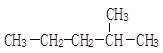 ________________ ;
________________ ;
(2)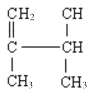 ______________________;
______________________;
(3)![]() ____________________;
____________________;
(4) ![]() _____________________;
_____________________;
(5)2,6-二甲基-4-乙基辛烷 ________________;
(6)2-甲基-1-戊烯 _____________________;
(7)3-甲基-1-丁炔 ___________________;
(8)![]() ____________________ (写名称);
____________________ (写名称);
(9)(CH3)2CHC(C2H5)2C(CH3)C2H5 ___________________________;
(10)间二氯苯 ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硝酸中的一步重要反应是NH3在加热条件下催化氧化:4NH3+5O2![]() 4NO+6H2O这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下列说法中错误的是
4NO+6H2O这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下列说法中错误的是
A.使用催化剂可以加快反应速率,提高生产效率
B.适当提高O2的浓度可以提高NH3的转化率
C.升高温度,正反应速率增大、逆反应速率减小
D.NH3的转化率为最大值时,该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y两根金属棒插入Z溶液中构成如图所示装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是下列中的( )

编号 | X | Y | Z |
A | Zn | Cu | 稀硫酸 |
B | Ag | Zn | 硝酸银溶液 |
C | Cu | Ag | 硫酸铜溶液 |
D | Cu | Zn | 稀硫酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8下列叙述正确的是
A. 该一元酸的电离方程式为HA = H++ A-
B. 该溶液中由水电离出的c(H+)=1×10-11mol·L-1
C. 该溶液中水的离子积常数为1×10-22
D. 将pH=11的NaOH溶液V1L与V2L 0.1 mol·L-1该一元酸(HA)溶液混合,若混合溶液的pH=7,则混合溶液中有关离子浓度为c(Na+)>c(OH-)>c(A-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)①④⑥三种元素构成的化合物的电子式:__;⑨的最高价氧化物对应水化物的化学式:__。
(2)⑤、⑦、⑧的简单离子半径由大到小的顺序:__(用离子符号填写)。
(3)用一个化学方程式表示④、⑤二种元素非金属性的强弱__。
(4)⑦的单质与⑥的最高价氧化物对应水化物的水溶液反应的离子方程式为__。
(5)元素①、元素④以原子个数比为1∶1形成化合物Q,元素①、元素③形成化合物M,Q和M的电子总数相等。以M为燃料,Q为氧化剂,可作火箭推进剂,最终产物对空气没有污染,写出该反应的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置应用于实验室制二氧化硫并验证其漂白性的实验,其中能达到实验目的的是

A.用装置甲制取二氧化硫
B.用装置乙收集二氧化硫
C.用装置丙验证二氧化硫的漂白性
D.用装置丁吸收二氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,Y与W同族,W的核电荷数是Y的两倍,四种元素组成的一种化合物如图所示。下列说法一定正确的是( )
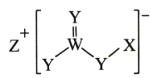
A.简单离子半径:Z>W>Y>X
B.最简单氢化物的稳定性:W>Y
C.X与Z可形成离子化合物ZX
D.W的氧化物对应的水化物为强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com