
【题目】已知浓硫酸的密度是1.84g/mL,物质的量浓度为18.4mol/L,质量分数为98%。取10mL浓硫酸和a mL水混合得到溶液的物质的量浓度为c mol/L,质量分数为b%。下列组合正确的是( )
(1)若c=9.2,则a<18.4,b>49 (2)若c=9.2,则a<18.4,b<49
(3)若b=49,则a=18.4,c<9.2 (4)若b=49,则a=18.4,c>9.2。
A.(1)(3)B.(1)(4)C.(2)(3)D.(2)(4)
【答案】A
【解析】
若b=49,稀释过程中溶质硫酸的质量不变,则:10mL×1.84g/mL×98g%=(10mL×1.84g/mL+a mL×1g/mL)×49%,解得a=18.4;令稀释后的密度为d g/mL,则d<1.84,稀硫酸的物质的量浓度c=![]() <9.2mol/L;
<9.2mol/L;
若c=9.2,令稀释后的密度为d g/mL,则d<1.84,稀释过程中溶质硫酸的物质的量不变,10mL×18.4mol/L=![]() ,所以a<18.4mL;
,所以a<18.4mL;
若c=9.2,则溶液体积变为20mL,令稀释后的密度为d g/mL,则d<1.84,稀释过程中溶质硫酸的质量不变,则:10mL×1.84g/mL×98g%=20mL×d g/mL×b%,则b>49;
故选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图是某化工厂对海水资源综合利用的示意图。根据以上信息,判断下列相关分析不正确的是

A.富集溴元素过程中,热空气吹出法利用了溴易挥发的性质
B.因氮气的化学性质相对稳定,冷却电解无水氯化镁所得的镁蒸气时,可选择氮气
C.反应⑥所用的气态氧化剂可从本厂生产烧碱处理循环利用或从本厂生产镁单质处理循环利用
D.MgCl2·6H2O必须在氯化氢氛围条件下加热制得无水氯化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
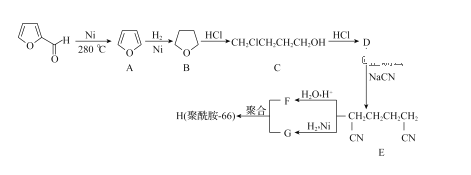
【题目】糠醛(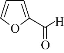 ),又称a一呋喃甲醛,是一种制备多种药物和化工产品的原料。一种由它制备锦纶-66的合成路线如图:
),又称a一呋喃甲醛,是一种制备多种药物和化工产品的原料。一种由它制备锦纶-66的合成路线如图:
已知:(1)R-CN![]() R-COOH R-CN
R-COOH R-CN![]() R-CH2NH2
R-CH2NH2
(2)RCHO+CH3CHO![]() RCH=CHCHO+H2O
RCH=CHCHO+H2O
回答下列问题:
(1)C中含有的官能团名称为______。
(2)有机物D的化学名称为________。
(3)由D生成E的反应类型为_______。
(4)写出F和G反应生成H的化学方程式:______。
(5)糠醛催化加氢后的产物为C5H10O2,与其互为同分异构体且属于酯的有机物共有_____种。
(6)以糠醛和乙醇为原料(其他试剂任选),设计制备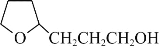 的合成路线。______
的合成路线。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+=Ca2++CO2↑+H2O
B.氯乙酸与足量的氢氧化钠溶液共热: CH2ClCOOH+OH- →CH2ClCOO-+H2O
C.苯酚钠溶液中通入少量二氧化碳: 2C6H5O-+CO2+H2O → 2C6H5OH+CO![]()
D.用银氨溶液检验乙醛中的醛基:CH3CHO +2[Ag(NH3)2]+ + 2OH- ![]() CH3COO-- + NH4+ +3NH3 + 2Ag↓+ H2O
CH3COO-- + NH4+ +3NH3 + 2Ag↓+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比) 后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为_____mol·L-1。
(2)取用任意体积的该盐溶液时,下列物理量中会随所取体积的多少而变化的是______(填字母)。
A.溶液中NaClO的物质的量 B.溶液的浓度 C.溶液中NaClO的摩尔质量 D.溶液的密度
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。回答下列问题。
①如图所示的仪器中,有些是不需要,配制上述溶液还需要_____________玻璃仪器

②需要称量NaClO固体的质量为_______ g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84g·cm-3)的浓硫酸配制230mL 2.3mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为________ mol·L-1。
②需用浓硫酸的体积为________ mL。
③若所配制的稀硫酸浓度偏小,则下列可能的原因分析中正确的是_______。
A.配制前,容量瓶中有少量蒸馏水 B.量取浓硫酸时,仰视液体的凹液面
C.未冷却,立即转移至容量瓶定容 D.定容时,仰视溶液的凹液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL MgCl2和AlCl3的混和溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH物质的量和所得沉淀的物质的量的关系如图所示。回答下列问题。

(1)图中CD段反应的化学方程式为___________;C点存在的固体物质为________。
(2)A点的数据为_______;混合液中,MgCl2的浓度为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)下列关于烷烃的表述正确的是
A. 乙烷的结构式为CH3CH3
B. C5H12分子的某种结构为![]()
C. ![]() 与
与 互为同分异构体
互为同分异构体
D. C4 H10的一氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的数目是
①12.0g熔融的NaHSO4中含有的阳离子数为0.2NA
②1mol Na2O 和Na2O2混合物中含有的阴、阴离子总数是3NA
③常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
④7.8g![]() 中含有的碳碳双键数目为0.3NA
中含有的碳碳双键数目为0.3NA
⑤用1L1.0 mol/LFeCl3溶液制备氢氧化铁胶体,所得氢氧化铁胶粒的数目为NA
⑥1mol SO2与足量O2在一定条件下充分反应生成SO3,共转移2NA个电子
⑦在反应KIO3+6HI=KI+3I2 +3H2O 中,每生成3molI2转移的电子数为5NA
⑧常温常压下,17 g甲基(-14CH3)中所含的中子数为9NA
A. 3 B. 4 C. 5 D. 6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com