
【题目】下列事实,不能用勒夏特列原理解释的是
A. 用排饱和氯化钠溶液的方法来收集氯气
B. 配制和保存硫酸铁溶液常加入适量稀硫酸
C. 向氢氧化镁悬浊液中加入饱和氯化铵溶液,溶液变澄清
D. 对2 HI (g)![]() H2 (g) + I2 (g)的平衡体系,增大压强使颜色变深
H2 (g) + I2 (g)的平衡体系,增大压强使颜色变深
【答案】D
【解析】A.排饱和氯化钠溶液的方法来收集氯气,相当于对Cl2+H2OH++Cl-+HClO加入NaCl,增大了Cl-的浓度,使平衡向逆反应方向移动,降低了氯气的溶解度,可用勒夏特列原理解释,故A不选;B、铁离子水解容易生成氢氧化铁,加入稀硫酸防止其水解,能用勒夏特列原理解释,故B不选;C. 向氢氧化镁悬浊液中加入饱和氯化铵溶液,氢氧根离子浓度减小,促进氢氧化镁溶解,溶液变澄清,能用勒夏特列原理解释,故C不选;D.增大压强使容器体积变小,碘浓度增大,所以颜色加深,但增大压强平衡不移动,所以不能用平衡移动原理解释,故D选;故选D。
点晴:使用勒夏特列原理时,必须注意研究对象必须为可逆反应,否则勒夏特列原理不适用,特别是改变平衡移动的因素不能用平衡移动原理解释,如催化剂的使用只能改变反应速率,不改变平衡移动,无法用勒夏特列原理解释。本题的易错点为A,要注意氯气与水的反应为可逆反应。


科目:高中化学 来源: 题型:
【题目】实验室需要配制240 mL 0.8 mol·L-1的NaOH溶液,请回答下列问题:
(1)称取NaOH固体______g。
(2)在配制该溶液过程中,需经过称量、溶解、转移溶液、定容等操作,下列图示对应的操作规范是______。根据图示,除称量外还缺少的操作步骤依次是___________、__________。
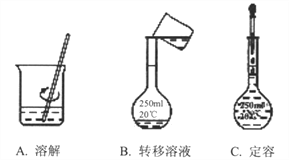
(3)在配制过程中,若其他操作都正确,下列操作会引起NaOH溶液浓度偏低的是__________。
A.称量好的固体放置一段时间后进行溶解操作
B.溶液未冷却至室温即转移到容量瓶中
C.容量瓶水洗后未干燥
D.转移溶液时不慎有少量溶液滴出瓶外
E.定容时不小心有蒸馏水滴出瓶外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色酸性溶液中能大量共存的一组离子是( )
A.Na+、K+、HCO3﹣、NO3﹣
B.NH4+、SO42﹣、Al3+、NO3﹣
C.Na+、Ca2+、NO3﹣、CO32﹣
D.K+、MnO4﹣、NH4+、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一块表面已部分被氧化为氧化钠的金属钠样品5.4g,将其投入94.7g 水中,放出1120mL H2(标准状况下)。
(1)请写出该样品放入水中时发生的反应的化学方程式:_______。滴加酚酞后溶液颜色_______,由此可知溶液呈_______ (“酸性”“碱性” 、 或“中性”)。
(2)样品中含金属钠_______g。
(3)所得的溶液的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,浓H2SO4既表现强氧化性又表现酸性的是( )
A. 2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
B. Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
C. S+2H2SO4(浓)![]() 3SO2↑+2H2O
3SO2↑+2H2O
D. Fe2O3+3H2SO4(浓) ===Fe2(SO4)3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学记录了有关硝酸的事实,你知道这些事实分别表现了硝酸的哪些性质?用“氧化性”、 “酸性” 、“不稳定性”、 “挥发性”填空,并写出有关反应方程式:
(1)久置的硝酸显黄:性质___________有关反应方程式为_______________________________
(2)铝制、铁制容器常温下可盛浓硝酸 : 性质______________
(3)铜片放入在稀硝酸中,溶液变为蓝色,产生无色气体:性质_________________________ 有关反应方程式为____________________
(4)碳单质放入热的浓硝酸中产生大量的红棕色气体:性质________________有关反应方程式为__________________________________________________________
(5)浓硝酸敞口放置在空气中,质量会减少:性质______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由S、Cl及Fe、Co、Ni等过渡元素组成的新型材料有着广泛的用途,回答下列问题:
(1)钴元素基态原子的电子排布式为_______,P、S、C1的第一电离能由大到小顺序为________。
(2)SCl2分子中的中心原子杂化轨道类型是_______,该分子空间构型为________。
(3)Fe、Co、Ni等过渡元素易与CO形成配合物,化学式遵循18电子规则:中心原子的价电子数加上配体提供的电子数之和等于18,如Ni与CO形成配合物化学式为Ni(CO)4,则Fe与CO形成配合物化学式为_______。Ni(CO)4中σ键与π键个数比为______,已知:Ni(CO)4熔点-19.3℃,沸点43℃,则Ni(CO)4为_______晶体。
(4)已知NiO的晶体结构如图1所示。

①NiO的晶体结构可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中。则NiO晶体中镍原子填充在氧原子形成的____体空隙中。
②已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO____NiO(填“>”、“<”或“=”),理由是_______________。
③一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充O2-形成的正三角形空隙中(如图2),己知O2-的半径为am,每平方米面积上分散的NiO的质量为______g。(用a、NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

下列说法正确的是( )
A. 沸点A2D<A2X
B. CA3分子是非极性分子
C. C形成的单质中σ键与π键个数之比为1∶2
D. B、C、D形成的气态氢化物互为等电子体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com