
科目:高中化学 来源: 题型:阅读理解
 (思维拓展题)某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
(思维拓展题)某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:| 负极材料 | 正极材料 | 负极反应式 | 正极反应式 | 电解质溶液 | |
| 实验三 | Zn | 杂质 | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |
| 实验四 | Zn | Cu | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |
| 负极材料 | 正极材料 | 负极反应式 | 正极反应式 | 电解质溶液 | |
| 实验三 | Zn | 杂质 | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |
| 实验四 | Zn | Cu | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片,同浓度盐酸做了下列平行实验:
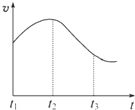
实验一、把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验二、把纯锌片投入到含FeCl3的同浓度工业盐酸中,发现放出氢气量减少。
实验三、将不纯的锌片与盐酸反应,发现反应速率加快。
实验四、在盐酸中滴入几滴CuCl2溶液,同样生成氢气速率加快。
问题:
(1)试分析实验一中t1~t2速率变化的主要原因是 ,t2~t3速率变化的主要原因是 。
(2)实验二放出氢气量减少的原因是 。
(3)某同学认为实验四反应速率加快原因,均为原电池的存在,你认为是否正确,若不正确,说明原因。若正确写出原电池的正、负极及电解质溶液。
查看答案和解析>>
科目:高中化学 来源:2012年苏教版高中化学选修6 6.2镀锌铁皮锌镀层厚度的测定练习卷(解析版) 题型:选择题
把锌片投入到下列溶液中,锌片溶解且溶液质量减轻,又没有气体产生的是( )
A.H2SO4 B.CuSO4
C.ZnSO4 D.AgNO3
查看答案和解析>>
科目:高中化学 来源:2014届广东省高一5月月考化学试卷(解析版) 题型:实验题
(10分)某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①:把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:

实验②:把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原是 ,t2~t3速率变化的主要原因是 。
(2)实验②放出氢气的量减少的原因是(用离子方程式表示) 。
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?
(填“正确”或“不正确”)。
请选择下列相应的a或b作答。
a、若不正确,请说明原因:
b、若正确则写出实验③中原电池的正极电极反应式:_________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com