


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
| A、随着原子序数增多,碱金属的原子半径逐渐增大 |
| B、卤素单质的熔沸点随着原子序数的增大而降低 |
| C、离子化合物中肯定含离子键 |
| D、原电池的负极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,下列叙述正确的有
,下列叙述正确的有查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠和镁分别与冷水反应,判断金属活动性强弱 |
| B、在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属活动性强弱 |
| C、硫酸与碳酸的酸性比较,判断硫与碳的非金属活动性强弱 |
| D、1moLBr2和1moLI2分别与足量的H2反应,判断溴与碘的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向水中通入氯气:Cl2+H2O═H++Cl-+HClO | ||||
B、在AlCl3溶液中加入过量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH
| ||||
C、将过量SO2通入Ca(ClO)2溶液中:Ca 2++ClO-+SO2+H2O
| ||||
D、向二氧化锰中滴加浓盐酸并加热:MnO2+4H++2Cl-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 烧杯编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| A2B溶液体积(mL) | 60 | 60 | 60 | 60 | 60 | 60 | 60 | 60 | 60 |
| CD2溶液体积(mL) | 0 | 20 | 40 | 50 | 60 | 70 | 80 | 100 | 120 |
| 沉淀质量(g) | 0 | 0.464 | 1.165 | 1.395 | 1.401 | 1.397 | 1.399 |
查看答案和解析>>
科目:高中化学 来源: 题型:
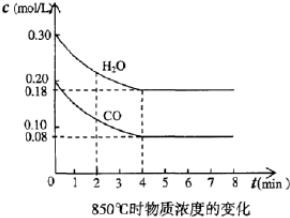
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com