
【题目】在铁制品上镀上一定厚度的锌层,以下方案设计正确的是( )
A.锌作阳极,镀件作阴极,溶液中含有锌离子
B.铂作阴极,镀件作阳极,溶液中含有锌离子
C.铁作阳极,镀件作阴极,溶液中含有亚铁离子
D.锌作阴极,镀件作阳极,溶液中含有锌离子
科目:高中化学 来源: 题型:
【题目】新型高效的甲烷燃料电池两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组进行如下的实验,根据装置图回答下列问题:
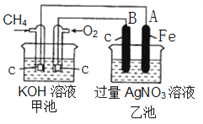
(1)通入CH4的电极的电极反应式是__________ ,A的电极反应式是______________ 。
(2)通电一段时间后,乙池中溶液的pH_________(填“升高”“降低”或“不变”),当乙池中某一电极质量增加 10.8g时,电路中有______ mol电子通过,理论上甲池中共消耗气体 _________mL(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯和乙烯都是石油化工最重要的基础原料,可用于生产多种重要的有机化工产品。主要的工业生产途径如下:
途径I:CH3CH2CH3(g) ![]() CH2=CHCH3(g)+H2(g) △H1
CH2=CHCH3(g)+H2(g) △H1
途径II :nCH3OH(g) ![]() CnH2n(g)+nH2O(g)(n为2或3) △H2<0
CnH2n(g)+nH2O(g)(n为2或3) △H2<0
回答下列问题:
(1)已知:丙烷、丙烯、氢气的燃烧热分别为2219.9 kJ·mol-1 、2056.5 kJ·mol-1 和285.8 kJ·mol-1 ,则△H1=________ kJ·mol-1 。
(2)途径I制备丙烯,要提高丙烯的产率最好采用____________条件。(填“高压”或“低压”)
(3)途径II控制适当的条件(温度、压强、催化剂等)可以调节N(N=n(乙烯)/n(丙烯))在0~1.5之向变化,回答下列问题:
①要大幅度提高丙烯在最终产物中的比率,需要控制的适当条件是______________________。
②在体积为1m3的反应器中投入0.64t甲醇,1h 后,反应器中的压强增加了30%,则甲醇的转化率为______(用N=1进行计算)。
(4)以丙烷为燃料制作新型燃料电池,电池的正极通入O2 和CO2,负极通入丙烷,电解质是熔融碳酸盐。
①写出该电池负极的电极反应式:_____________,CO32-移向电池的___极 (填“正”或“负”)。
②当电池消耗0.005mol C3H8时,正极消耗气体的总体积为_____L (标准状况下)。
③用该电池电解1000mL1mol/L的AgNO3溶液、此电解池的总反应方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,热化学方程式中反应热数值最大的是
A.2W(l)+Y(l)→2Z(g) +Q1B.2W(g)+Y(g)→2Z(l) +Q2
C.2W(g)+Y(g)→2Z(g) +Q3D.2W(l)+Y(l)→2Z(l) +Q4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙烯和苯的叙述中,错误的是( )
A. 乙烯能发生加聚反应 B. 乙烯可以燃烧
C. 苯能使酸性高锰酸钾溶液褪色 D. 苯分子中6个碳碳化学键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为KW.该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A. a=b B. 混合溶液中,c(H+)+c(B+)=c(OH﹣)+c(A﹣)
C. 混合溶液的pH=7 D. 混合溶液中,c(H+)=![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组的同学用图所示的实验装置进行电解反应,电解槽内装有KI﹣淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.
已知:3I2+6OH﹣═IO3﹣+5I﹣+3H2O
回答下列问题:
(1)左侧为电源极.(填“正”或“负”)
(2)请用方程式及必要的文字解释左侧溶液变蓝色的原因? .
(3)写出右侧发生的有关电极反应的反应式: .
(4)电解反应结束时,左侧溶液中还I﹣ . (填“有”或“没有”)
(5)写出电解槽内发生反应的总化学方程式: .
(6)如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应 . (填“变”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸钠稳定性远髙于次氯酸钠,也可用于杀菌消毒。制备次氯酸钠方法较多,常用的一种合成路线如下:

已知:1.次氯酸叔丁酯((CH3)3COCl),相对分子质量为108.5,是具有挥发性的黄色油状液体,密度为0.802g/mL,且有强烈刺激性臭味;2.(CH3)3COCl+LiOH=LiClO+(CH3)3COH
请回答:
(1)实验第一步的反应装置如图所示(夹持装置省略),B装置中支管的作用是___________;浓盐酸逐滴滴加而不是一次性加入的原因是_______________。

(2)请写出在装置A中发生反应的化学方程式___________________。
(3)对于操作1,下列说法不正确的是__________。
A.可以选用250mL规格的分液漏斗
B.操作1须在通风橱内进行
C.进行分液时,可提早关闭旋塞,以防止次氯酸叔丁酯从下口流出
D.装置B不合适进行操作1
(4)进行操作3时,并不是直接加热蒸发溶液,而是选择在40°C下缓慢蒸发溶液,试解释其原因 __________。
(5)该实验中次氯酸锂的产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1为甲烷和O2构成的燃料电池示意图,电解质溶液为KOH溶液;图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是

A. b电极为负极
B. 图1中电解质溶液的pH增大
C. a电极反应式为CH4-8e-+8OH-=CO2+6H2O
D. 图2中电解AlCl3溶液的总反应式为: 2AlCl3+6H2O ![]() 2Al(OH)3↓+3Cl2↑+3H2↑
2Al(OH)3↓+3Cl2↑+3H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com