
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成; ②球棍模型为: 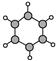 |
| C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. |
| D | ①相对分子质量比C少2; ②能由C氧化而成; |
| E | ①由C、H、O三种元素组成; ②球棍模型为: 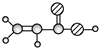 |
 .
. .
.分析 由上述信息可知,A为CH2=CH2,B为苯,C为CH3CH2OH,D为CH3CHO,E为CH2=CHCOOH,
(1)乙烯与溴水发生加成反应,乙烯发生加聚反应生成聚乙烯;
(2)乙烯与氢气加成生成乙烷,烷烃中从丁烷开始出现同分异构体;
(3)结合苯的性质来解答;
(4)C与E反应发生酯化反应;
(5)乙醇催化氧化生成乙醛.
解答 解:由上述信息可知,A为CH2=CH2,B为苯,C为CH3CH2OH,D为CH3CHO,E为CH2=CHCOOH,
(1)乙烯与溴水发生加成反应生成1,2-二溴乙烷,乙烯发生加聚反应生成聚乙烯,该反应为nCH2=CH2→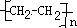 ,
,
故答案为:1,2-二溴乙烷;nCH2=CH2→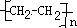 ;
;
(2)乙烯与氢气加成生成乙烷,烷烃中从丁烷开始出现同分异构体,丁烷中n=4,故答案为:4;
(3)苯的性质为①无色芳香气味液体、②有毒、③不溶于水,在一定条件下与氢气发生加成反应,不与高锰酸钾、溴水反应,易发生取代反应,苯的硝化反应为 ,故答案为:②③;
,故答案为:②③; ;
;
(4)C与E反应发生酯化反应,该反应为CH3CH2OH+CH2=CHCOOH$?_{△}^{浓硫酸}$CH2=CHCOOCH2CH3+H2O,
故答案为:酯化反应;CH3CH2OH+CH2=CHCOOH$?_{△}^{浓硫酸}$CH2=CHCOOCH2CH3+H2O;
(5)乙醇催化氧化生成乙醛,该反应为2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.
点评 本题考查有机物的结构与性质,注意把握有机物中的官能团与性质的关系,熟悉常见有机物的性质即可解答,总结归纳常见有机反应类型及特点,题目难度不大.


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:计算题
| 次数 | 第1次 | 第2次 |
| 加入稀盐酸的质量/g | 50 | 50 |
| 剩余固体的质量/g | 2.6 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应CH4+H2O $\frac{\underline{催化剂}}{△}$3H2+CO,每消耗1 mol CH4转移12 mol电子 | |
| B. | 电极A上H2参与的电极反应为:H2+2OH--2e-═2H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-═2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④⑥ | B. | 只有①⑤⑥ | C. | 只有②③④ | D. | 只有③⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 △H=+88.6kJ/mol
△H=+88.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1.12L CCl4中含有C-Cl键数目为0.2NA | |
| B. | 标准状况下,2.24L氯气中含有${\;}_{17}^{35}$Cl数目一定为0.2NA | |
| C. | 常温常压下,4.4g CO2与N2O混合气体中含有的原子总数为0.3NA | |
| D. | 80 mL 10 mol•L-1 盐酸与足量MnO2加热反应,产生Cl2的体积为4.48L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com