
| A. | rF:rCl | B. | rI-:rI | C. | rMg2+:rNa+ | D. | rNa+:rNa |
分析 同种元素的阳离子半径小于原子半径,同种元素的阴离子半径大于原子半径,同周期元素的原子半径从左向右在减小,同主族元素电子层数越多半径越大,以此来解答.
解答 解:A.同主族元素的原子,原子序数越大,半径越大,所以Cl原子半径大于F原子,则rF:rCl小于1,故A错误;
B.因同种元素的阴离子半径大于原子半径,则rI-:rI大于1,故B正确;
C.同周期元素的原子序数越大,其阳离子的半径越小,所以Mg2+半径小于Na+半径,故rMg2+:rNa+小于1,故C错误;
D.因同种元素的阳离子半径小于原子半径,则rNa+:rNa小于1,故D错误;
故选B.
点评 本题考查微粒半径的比较,明确原子半径的比较方法、离子半径与原子半径的关系即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 据反应3NO2+H2O═2HNO3+NO可知,NO2是HNO3的酸酐 | |
| B. | 据反应2NO2(g)?N2O4(g)△<0可知要制得较纯净的NO2,需高温、低压环境 | |
| C. | 据反应Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O和3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,可知浓HNO3的氧化性不如稀HNO3强 | |
| D. | NO2、Br2(g)同为红棕色气体,可用湿润的淀粉-KI试纸鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
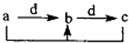 如表各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
如表各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )物质 选项 | a | b | c | d |
| A | Al | Al(OH)3 | NaAlO2 | NaOH |
| B | N2 | NO | NO2 | O2 |
| C | Na2CO3 | NaHCO3 | NaOH | CO2 |
| D | Cl2 | FeCl3 | FeCl2 | Fe |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧杯中有Fe无Cu | B. | 烧杯中有Cu无Fe | C. | 烧杯中Fe、Cu都有 | D. | 烧杯中Fe、Cu皆无 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,Na2O2的电子式
,Na2O2的电子式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com