
【题目】现用CCl4从溶有碘的氯化钠溶液中萃取碘并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL混合溶液和15mL CCl4加入分液漏斗中,并盖好玻璃塞;
C.检查分液漏斗活塞和上口的玻璃塞是否漏夜;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
H.静置,分层。
就此实验,完成下列填空:
(1)正确操作步骤的顺序是(用上述各操作的编号字母填写)____
![]()
![]()
![]() A
A![]() G
G![]() E
E![]() F。
F。
(2)上述E步骤的操作中应注意___;上述G步骤操作的目的是____。
(3)已知碘在酒精中的溶解度比在水中的大得多,能不能用酒精来萃取碘水中的碘___(填“能”或“不能”),其理由是____。
【答案】C→B→D→A→G→H→E→F 分液漏斗下口紧靠烧杯内壁 使分液漏斗内外相通,保持液体顺利流出 不能 酒精与水互溶
【解析】
(1)萃取的步骤:溶液和萃取液分别倒入分液漏斗,把分液漏斗倒转过来用力振荡,将分液漏斗放在铁架台上静置,待液体分层后,将漏斗上端玻璃塞打开,从下端放出下层液体,上端倒出上层液体;
(2)从分液漏斗中流出液体是通过大气压强控制的;
(3)萃取剂必须具备下列条件:两种溶剂互不相溶;溶质在萃取剂中的溶解度大于在原溶剂中的溶解度;溶质与萃取剂不反应;
(1)萃取的步骤:检验分液漏斗活塞和上口的玻璃塞是否漏液,溶液和萃取液分别倒入分液漏斗,把分液漏斗倒转过来用力振荡,将分液漏斗放在铁架台上静置,待液体分层后,将漏斗上端玻璃塞打开,从下端放出下层液体,上端倒出上层液体;正确操作步骤的顺序是C→B→D→A→G→H→E→F;
(2)旋开活塞,用烧杯接收溶液时,注意分液漏斗下口紧靠烧杯内壁,液体沿烧杯内壁流下;从分液漏斗中流出液体是通过大气压强控制的,将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔,使分液漏斗内外相通,保持液体顺利流出;
(3)酒精与水互溶,加入酒精,不分层,所以不能用酒精来萃取碘水中的碘。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 电解饱和MgCl2溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B. 向酸性KMnO4溶液中通入SO2:3SO2+2MnO4-+4OH-===2MnO2↓+3SO42-+2H2O
C. 向Fe(NO3)2稀溶液中滴加足量氢碘酸:3Fe2++NO3-+4H+===3Fe3++NO↑+2H2O
D. 向NaClO溶液中通入足量CO2:ClO-+CO2+H2O===HClO+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法中正确的是( )
①0.5mol O3与11.2L O2所含的分子数一定相等
②标准状况下,28g CO与N2的混合气体的体积约为22.4L
③通常状况下,NA个CO2分子占有的体积为22.4L
④常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
⑤常温下,4.4g CO2和N2O(不反应)混合物中所含有的电数为2.2NA
⑥标准状况下,22.4L SO3含有的分子数为NA
⑧在常温常压下,1mol O2含有的原子数为2NA
A. ①③⑥⑧B. ②④⑤⑧C. ①③⑤⑧D. ②③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-115. 6 kJ·mol-1, H2(g)+Cl2(g)=
2Cl2(g)+2H2O(g) ΔH=-115. 6 kJ·mol-1, H2(g)+Cl2(g)=
2HCl(g)ΔH=-184 kJ·mol-1。
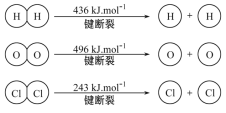
①H2与O2反应生成气态水的热化学方程式是___________。
②断开1 mol H—O键所需能量为______ kJ。
③高温下H2O可分解生成分子或原子。高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是________,物质的量之比为2:1的A、H2化学能较低的物质是________。

(2)已知ΔG=ΔH—T·ΔS。在100 kPa、298. 15 K时石灰石分解反应CaCO3(s)= CaO(s)+CO2(g)的ΔH=+178. 3 kJ·mol-1,ΔS=+160. 4 J·mol-1·K-1
①从吉布斯自由能变(ΔG)的角度说明该反应高温下能自发进行的原因___________________。
②则该反应自发进行的最低温度为__________K。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过计算填写下列内容:
(1)2.5mol H2SO4的质量是_________。
(2)6.02×1023个氨分子(NH3)含_________mol质子。
(3)等质量的氧气和臭氧,他们原子的个数之比为_________。
(4)12g某二价金属的硫酸盐中,含有0.1mol SO42-,该金属的相对原子质量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组比较中正确的是
A. 熔点:Li<Na<K
B. 稳定性:CH4<NH3<H2O<HF
C. 酸性:HClO4<H2SO4<H3PO4
D. 还原性:Br-<Cl-<S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Co3O4是一种电极材料,可用草酸盐湿式沉淀—煅烧分解法制备。
(1)先用(NH4)2C2O4溶液和CoCl2溶液为原料制取难溶于水的CoC2O4·2H2O晶体。
①已知25 ℃,Kb(NH3·H2O)=1.8×10-5,H2C2O4的Ka1=5.6×10-2,Ka2=5.4×10-5。(NH4)2C2O4溶液的pH__ (填“>”“=”或“<”)7。
②反应时,使(NH4)2C2O4过量的原因是________________________。
(2) 为确定由CoC2O4·2H2O获得Co3O4的最佳煅烧温度,准确称取4.575 g的CoC2O4·2H2O样品,在空气中加热,固体样品的剩余质量随温度的变化如图所示(已知385 ℃以上残留固体均为金属氧化物)

①B处的物质为________(填化学式)。
②经测定,205~385 ℃的煅烧过程中,产生的气体为CO2,计算AB段消耗O2在标准状况下的体积。(写出计算过程,结果保留2位有效数字) ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氰酸(HCN)是一种剧毒类弱酸,具有苦杏仁气味,将其加水不断稀释,下列各量始终保持增大的是
A. Ka(HCN) B. c(H+) C. c(CN-)/c(HCN) D. C(HCN)/ c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类研究的重要课题,目前工业合成氨的原理为:N2(g) + 3H2(g) ![]() 2NH3(g) ΔH=-93.0kJ/mol
2NH3(g) ΔH=-93.0kJ/mol
(1)某温度下,在2 L密闭容器中发生上述反应,测得数据如下:
时间/h 物质的量/mol | 0 | 1 | 2 | 3 | 4 |
N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
①0~2 h内,v(N2)=____________。
②平衡时,H2的转化率为______;
该温度下,反应2NH3(g)![]() N2(g) + 3H2(g) 的平衡常数K=_______ (mol/L)2。
N2(g) + 3H2(g) 的平衡常数K=_______ (mol/L)2。
③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3的浓度与上表中相同的为_______(填选项字母)。
A.a=l、b=3、c=0 B.a=4、b=12、c=0
C.a=0、b=0、c=4 D.a=l、b=3、c=2
(2)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热ΔH=-286.0kJ/mol,则用N2与水反应制NH3的热化学方程式为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com