
| V |
| Vm |
| CO物质的量 |
| 混合气体总物质的量 |
| m |
| n |
| 17.92L |
| 22.4L/mol |
|
| 0.2mol |
| 0.8mol |
| 32g |
| 0.8mol |


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、自来水用氯气消毒是因为氯气有毒,可毒死细菌、病毒 |
| B、道尔顿的原子学说存在缺陷和错误,因而意义不大 |
| C、焙制糕点时的发酵粉以小苏打为主要成分 |
| D、做焰色反应时,蘸取样品之前需用氢氧化钠溶液清洗铂丝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
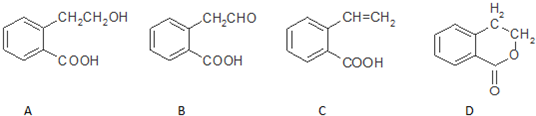
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)日常生活中,我们经常饮用矿泉水.如图是某饮用天然水部分商标图,图中列出了理化指标.据此回答:这里的钙、镁、钾、钠指的是
(1)日常生活中,我们经常饮用矿泉水.如图是某饮用天然水部分商标图,图中列出了理化指标.据此回答:这里的钙、镁、钾、钠指的是| 熔点(℃) | 密度 (g/cm3) | 硬度 (金刚石为10) | 导电性 (银为100) | |
| 某合金 | 2500 | 3.00 | 7.4 | 2.3 |
| 铁 | 1535 | 7.86 | 4.5 | 17 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)硼酸(H3BO3)溶液中存在如下平衡:
(1)硼酸(H3BO3)溶液中存在如下平衡:| 化学式 | H2CO3 | CH3COOH |
| 电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C三种短周期元素在周期表中相对位置如表格:
A、B、C三种短周期元素在周期表中相对位置如表格:| A | |||
| B | C |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com