
| A. | 一个 | B. | 二个 | C. | 三个 | D. | 四个 |
分析 ①氧气和臭氧都是由氧原子构成,依据N=$\frac{m}{M}$×NA计算;
②完全反应0.2mol硫酸会生成0.1mol二氧化硫,转移了0.2mol电子,由于铜与稀硫酸不反应,转移的电子的物质的量小于0.2mol;
③CaCO3和Mg3N2摩尔质量都是100g/mol,1mol碳酸钙含有50mol质子,1molMg3N2含有50mol质子;
④1个二氧化硫和1个三氧化硫都含有1个硫原子.
解答 解:①21g氧气和27g臭氧含有氧原子质量为48g,则氧原子个数为$\frac{48g}{16g/mol}$×NA=3NA,故正确;
②随着反应的进行,浓硫酸变成稀硫酸,反应停止,所以反应生成的二氧化硫小于0.1mol,转移的电子小于0.2mol,转移电子数小于0.2NA,故正确;
③0.6gCaCO3和Mg3N2的混合物物质的量为$\frac{0.6g}{100g/mol}$=0.006mol,所含质子数为0.006mol×50×NA=0.3NA,故正确;
④1个二氧化硫和1个三氧化硫都含有1个硫原子,等物质的量的SO2和SO3中含S原子数相等,但是不一定为NA,故错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气混合后光照发生反应 | B. | 乙炔与氯气的加成反应 | ||
| C. | 乙烯与氯化氢的加成反应 | D. | 二氧化碳通入石灰水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500mL | B. | 600mL | C. | 650mL | D. | 700mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取溶解后待测液少许,先加少量氯水,再加KSCN产生血红色溶液,则有Fe2+ | |
| B. | 步骤3的离子方程式为:5C2O42-+2MnO${\;}_{4}^{-}$+8H2O=10CO2↑+2Mn2++16OH- | |
| C. | x:z=1:2 | |
| D. | 该晶体的化学式为:K3[Fe(C2O4)3]•3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n+m | 2 | |
| VSEPR理想模型 | 正四面体形 | |
| 价层电子对 之间的理想键角 | 109°28′ |
| 分子 | |||
| 或离子 | SnCl2 | CCl4 | ClO${\;}_{4}^{-}$ |
| 立体构型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
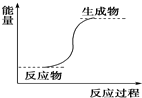
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 铝与稀盐酸 | ||
| C. | NaOH与HCl的反应 | D. | 甲烷与O2的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 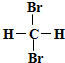 和 和 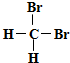 是同一物质 是同一物质 | |
| B. | 1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但它不能解释的事实是邻二溴苯只有一种. | |
| C. | 某有机物化学式为C3H6O2,其核磁共振氢谱有三个峰,其强度比为3:2:1,则该有机物的结构简式一定是CH3CH2COOH | |
| D. | 在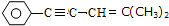 分子中一定共面的碳原子最多为9个,可能共面的碳原子最多为12个 分子中一定共面的碳原子最多为9个,可能共面的碳原子最多为12个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com