分析:(1)16g液态甲醇(CH
3OH)完全燃烧,放出热量363.3kJ,则1molCH
3OH完全燃烧,放出热量为726.6kJ,所以可以写出热化学方程式为:CH
3OH(l)+
O
2(g)=CO
2(g)+2H
2O(l)△H=-726.6KJ/mol,据此答题;
(2)①根据平衡常数的定义,结合化学方程式可以写出表达式;
②根据v=
计算,转化率=
×100%;
③根据平衡状态的判断标志进行判断;
④根据平衡移动的影响因素判断;
(3)根据原电池原理,2CH
3OH+3O
2+4OH
-=2CO
32-+6H
2O中甲醇为还原剂,反应中失去电子,所以在负极反应,氧气得电子,在正极反应,据此答题.
解答:
解:(1)16g液态甲醇(CH
3OH)完全燃烧,放出热量363.3kJ,则1molCH
3OH完全燃烧,放出热量为726.6kJ,所以可以写出热化学方程式为:CH
3OH(l)+
O
2(g)=CO
2(g)+2H
2O(l)△H=-726.6KJ/mol,故答案为:CH
3OH(l)+
O
2(g)=CO
2(g)+2H
2O(l)△H=-726.6KJ/mol;
(2)①平衡常数等于生成浓度系数次幂之积除以反应物浓度系数次幂之积,所以K=
| c(CH3OH)?c(H2O) |
| c3(H2)?c(CO2) |
,故答案为:
| c(CH3OH)?c(H2O) |
| c3(H2)?c(CO2) |
;
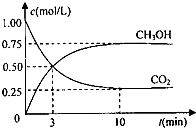
②根据图象可知生成CH
3OH的浓度为0.75mol/L,所以v=
=
=0.075mol/(L?min),参加反应的二氧化碳的物质的量为0.75mol/L×1L=0.75mol,根据化学方程式可知,参加反应的氢气的物质的量为0.75mol×3=2.25mol,转化率=
×100%=75%,
故答案为:0.075mol/(L?min);75%;
③A.消耗CO
2的同时生成 CH
3OH,都是指的正反应,不能反映出正逆反应速率的关系,故不能说明反应是否处于平衡状态;
B.CO
2、H
2、CH
3OH和H
2O的物质的量的比与起始加入的量有关与反应是否处于平衡状态无关,故不能说明反应是否处于平衡状态;
C.该反应为气体体积减小的反应,即压强也减小的反应,所以当容器中气体的压强不再改变时,就说明反应已经处于平衡状态;
D.该反应容器体积不变,反应前后气体质量守恒,所以容器中气体的密度始终不变,所以不能根据密度的变化判断反应是否处于平衡状态;
故选C;
④A.该反应为放热反应,升高温度平衡逆向移动,故A错误;
B.将CH
3OH(g)从体系中分离,即减小生成物浓度,平衡正向移动,故B正确;
C.使用高效催化剂对平衡移动没有影响,所以平衡不移动,故C错误;
D.恒温恒容再充入1molCO
2和3mol H
2,相当于加压,由于反应是气体体积减小的反应,所以平衡正向移动,故D正确;
故选BD;
(3)根据原电池原理,2CH
3OH+3O
2+4OH
-=2CO
32-+6H
2O中甲醇为还原剂,反应中失去电子,所以在负极反应,氧气得电子,在正极反应,生成氢氧根离子,方程式为:3O
2+12e
-+6H
2O=12OH
-,故答案为:负;3O
2+12e
-+6H
2O=12OH
-.

 为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.
为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.

 实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L?s)]与反应时间t(s)的关系如图所示.该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L?s)]与反应时间t(s)的关系如图所示.该反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O