
100ml2mol/L的稀硫酸与过量的锌反应,为加快反应速率,又不影响氢气的总量,可采用的方法是
| A.不用稀硫酸,改用98﹪浓硫酸 | B.加入数滴氯化铜溶液 |
| C.加入适量的蒸馏水 | D.加入更多锌片 |
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
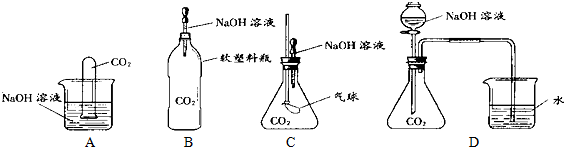
| 实验步骤 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
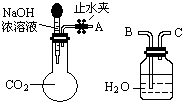 Ⅰ.纯碱、烧碱等是重要的化工原料.
Ⅰ.纯碱、烧碱等是重要的化工原料.| 实验操作 | 实验现象 | 结论 |
| ①取少量白色固体于试管中,加水溶解,再加足量BaCl2溶液 | ||
| ②过滤,取2mL滤液于试管中, |
原白色固体中有OH-存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(Fe)=0.5mol/(L?min) | B、v(H2SO4)=1mol/(L?min) | C、v(FeSO4)=0.5mol/(L?min) | D、v(H2)=0.5mol/(L?min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com