
 氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如表:
氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如表:| 温度/℃ | 200 | 300 | 400 | 500 | 600 |
| 氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
分析 (1)根据表格数据可知温度升高,合成氨平衡混合气体中NH3的体积分数减少,说明平衡逆向移动,而温度升高,平衡向吸热的方向移动;
(2)根据图写出热化学方程式.注意反应热与物质的量的关系;
(3)根据可逆反应进行不彻底的特点来解答,催化剂改变反应速率不改变化学平衡,反应焓变不变;
(4)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算焓变=反应物总键能-生成物的总键能,以此计算;
(5)依据热化学方程式的意义和盖斯定律的内容通过合并计算得到热化学方程式.
解答 解:(1)由表格数据可知温度升高,合成氨平衡混合气体中NH3的体积分数减少,说明平衡逆向移动,而温度升高,平衡向吸热的方向移动,则合成氨反应是放热反应;
故答案为:温度升高,合成氨平衡混合气体中NH3的体积分数减少,说明平衡逆向移动,而温度升高,平衡向吸热的方向移动,则合成氨反应是放热反应;
(2)由图可知,$\frac{1}{2}$molN2(g)与$\frac{3}{2}$molH2(g)完全反应生成1molNH3(g)的反应热为-46.1kJ/mol,
所以合成氨的热化学反应方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92.2 kJ•mol-1;
(3)反应是可逆反应,反应物不能完全转化,3mol H2,1mol N2充分参与反应也不可能生成2molNH3,故放出的热量小于92KJ的热量,催化剂改变反应速率不改变化学平衡,反应焓变不变;
故答案为:小于;由于该反应是可逆反应,反应物无法全部转化为生成物;不变;
(4)已知:分别破坏1mol N≡N键、1mol H-H键需要吸收的能量为:946kJ、436kJ,设破坏1mol N-H键需要吸收的能量为x,N2(g)+3H2(g)?2NH3(g)△H=-92.2 kJ•mol-1,焓变=反应物总键能-生成物的总键能,946kJ/mol+3×436kJ/mol-6x=92.2KJ/mol,x=391KJ/mol,破坏1mol N-H键需要吸收的能量为:391KJ;
故答案为:391;
(5)①N2(g)+O2(g)=2NO2(g)△H1=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534kJ/mol
依据盖斯定律:②×2-①得到:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol,1mol N2H4与NO2完全反应的热化学方程式为:N2H4(g)+NO2(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-567.85 kJ•mol-1;
故答案为:N2H4(g)+NO2(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-567.85 kJ•mol-1.
点评 本题考查了热化学方程式的书写方法和盖斯定律的计算应用,依据键能计算焓变,注意可逆反应不能进行彻底,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ | |
| B. | 向Fe(OH)3胶体中加入氢碘酸溶液:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 将NaClO溶液与亚硫酸钠溶液混合:ClO-+SO32-═SO42-+Cl- | |
| D. | 用石墨作电极电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 绿原酸被誉为“第七类营养素”,具有广泛的杀菌、消炎功能,其结构简式如图所示.下列有关绿原酸的说法中正确的是( )
绿原酸被誉为“第七类营养素”,具有广泛的杀菌、消炎功能,其结构简式如图所示.下列有关绿原酸的说法中正确的是( )| A. | 绿原酸分子中含有3种官能团 | |
| B. | 1 mol绿原酸最多能与7molNaOH发生反应 | |
| C. | 绿原酸能发生取代反应、加成反应和消去反应 | |
| D. | 绿原酸能使酸性高锰酸钾溶液、浓溴水褪色,反应原理同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4的水溶液不易导电,故BaSO4是非电解质 | |
| B. | 烧碱、纯碱、盐酸均为电解质 | |
| C. | 金刚石、石墨均属于单质 | |
| D. | 溶液导电性强弱只取决于溶液中所含离子浓度的大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液与醋酸反应 | B. | 氢氧化钙与稀盐酸反应 | ||
| C. | 氢氧化钡与稀硫酸反应 | D. | 氢氧化钾与稀硝酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
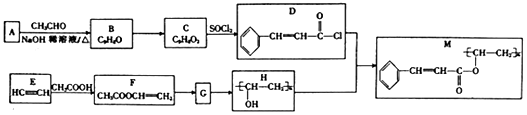
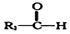 +
+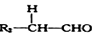 $→_{△}^{NaOH稀溶液}$
$→_{△}^{NaOH稀溶液}$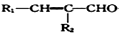 +H2O(R1、R2为羟基或氯)
+H2O(R1、R2为羟基或氯) .
.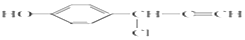 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向稀硝酸与过量铜粉反应后的溶液中滴加稀硫酸 | 有气泡生成 | 常温下,铜与稀硫酸反应生成SO2 |
| B | 在酒精灯上加热铝箔 | 铝熔化,但熔化的铝不滴落 | Al2O3的熔点比Al高 |
| C | 向Fe(SCN)3溶液中滴加稀NaOH溶液 | 溶液由红色变为红褐色 | 减小反应物浓度、平衡向逆反应方向移动 |
| D | 选用酚酞作试剂,用NaOH溶液滴定醋酸溶液 | 溶液变为粉红色 | NaOH溶液过量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com