
【题目】可逆反应 A(g)+3B(g)![]() 2C(g)+2D(g),在不同情况下,测得有下列四个反应速率,其反应速率最快的是( )
2C(g)+2D(g),在不同情况下,测得有下列四个反应速率,其反应速率最快的是( )
A. v(A)=0.15molL﹣1s﹣1B. v(B)=0.6molL﹣1s﹣1
C. v(C)=0.5molL﹣1s﹣1D. v(D)=0.4molL﹣1s﹣1
科目:高中化学 来源: 题型:
【题目】三聚氰胺(结构简式如图所示)是一种重要的化工原料,可用于阻燃剂、水泥减水剂和高分子合成等领域。一些不法分子却往牛奶中加入三聚氰胺,以提高奶制品的含氮量。下列说法正确的是
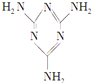
A. 三聚氰胺是一种蛋白质B. 三聚氰胺不是高分子化合物
C. 三聚氰胺分子中含有碳碳双键D. 三聚氰胺的分子式为C3H6N6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产C1O2的工艺主要包括:①粗盐精制;②电解微酸性NaC1溶液;③C1O2的制取。工艺流程如下图:
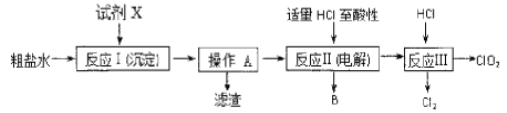
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液
(1)粗食盐水中含有Ca2+、Mg2+、![]() 等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是__________________________(填化学式)。
等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,选出试剂X所代表的试剂,按滴加顺序依次为是__________________________(填化学式)。
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成C1O2。反应Ⅲ的化学方程式为______________。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知ClO2+I-+H+==I2+Cl-+H2O未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知:![]() )
)
①准确量取10.00 mL ClO2溶液的玻璃仪器是__________________。
②上述步骤3中滴定终点的现象是__________________________。
③若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果_________(填“偏高”、“偏低”或“无影响”)
④根据上述步骤可计算出原C1O2溶液的浓度为_________mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84消毒液”能有效杀灭甲型H1N1等病毒,某同学昀买了 一瓶“84消毒液”,并査阅相关资料和消毒液包装说明得到 如下信息:“84消毒液”含25%NaC10、1000 mL、密度 1. 192 g/cm 3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”中NaClO的物质的量浓度为________ mol/L。
(2)该同学取100 mL稀释后的消毒液用于消毒,稀释后溶液中 c(Na+)为_______mol/L。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含4. 0 mol/L NaClO的消毒液。下列说法正确的是________(填序号)。
A.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
B.利用购买的商品NaClO来配制,可能导致结果偏低
C.需要称量NaClO固体的质量为143. 0 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应属于氧化还原反应但不属于四种基本反应类型的是
A.4Fe(OH)2+O2+2H2O =4Fe(OH)3
B.Cl2+ H2O![]() HCl+ HClO
HCl+ HClO
C.NaHCO3+HCl=NaCl+H2O + CO2↑
D.C+H2O = CO↑+ H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。

根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反-10-羟基-2-癸烯酸(HO![]() COOH)简称10-HDA,在自然界只存在于蜂王浆中,所以也称为王浆酸,有很好的杀菌、抑菌作用和抗癌、抗辐射的功能。王浆酸的一种人工合成路线设计如下:
COOH)简称10-HDA,在自然界只存在于蜂王浆中,所以也称为王浆酸,有很好的杀菌、抑菌作用和抗癌、抗辐射的功能。王浆酸的一种人工合成路线设计如下:
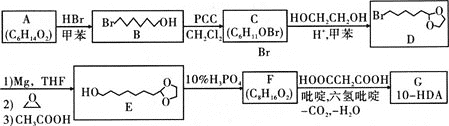
已知:1mol A与足量金属钠反应生成1mol H2;C、F都能发生银镜反应
回答下列问题:
(1)A的化学名称为________;A生成B的反应类型为________;D的分子式为________;F的结构简式为________。
(2)若用金属铜催化氧化B生成C,其化学方程式为________。
(3)由C→D、E→F的转化,可推断此设计的目的是________。
(4)G的同分异构体中能同时满足下列条件的共有________种(不考虑立体异构);
①能与饱和碳酸氢钠溶液反应产生气体
②含六元环醚结构和正丁基(-CH2CH2CH2CH3)
其中核磁共振氢谱显示为7组峰的是________(写结构简式)。
(5)G与酸或醇都能发生酯化反应。酸催化下酯化反应的历程可表示为(箭头表示原子或电子的迁移方向):
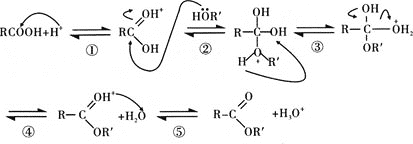
据此完成4-羟基丁酸在酸催化下生成4-羟基丁酸内酯的反应历程:_______
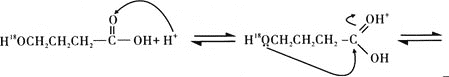
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有酚酞的NaOH溶液中,逐滴滴入新制氯水,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去而得无色溶液。根据预测,实验中溶液红色褪去的原因可能有两种,试回答下列问题:
(1)新制氯水成分:__________________________________________________。
(2)请用简要的文字说明溶液红色褪去的原因可能有两种
①___________________________________________________________________________。
②___________________________________________________________________________。
(3)通过实验进一步探究溶液红色褪去的原因究竟是上述中的①还是②。
a.取试管内的无色溶液3mL盛于另一支洁净的试管中;
b.__________________________________________________________,振荡试管,
(实验现象及结论)
Ⅰ若________________________,则证明溶液红色褪去的原因是①而不是②;
Ⅱ若________________________,则证明溶液红色褪去的原因是②而不是①。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com