
| A. | 水浴加热 | B. | 将稀硫酸改为98%的浓硫酸 | ||
| C. | 滴加少许CuSO4溶液 | D. | 改用铁粉并振荡 |
科目:高中化学 来源: 题型:实验题
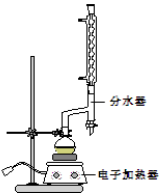 苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为:
苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等.其制备方法为: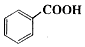 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$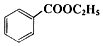 +H2O
+H2O| 颜色、状态 | 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸* | 无色片状晶休 | 249 | 1.2659 |
| 苯甲酸乙酯 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 无色澄清液体 | 80.8 | 0.7318 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
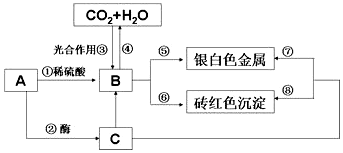
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | m+n>p | B. | 平衡向逆反应方向移动 | ||
| C. | A的转化率减小 | D. | C的体积分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
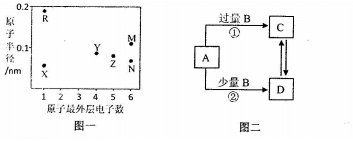
 .
. ,它能与双氧水在酸性条件下反应,生成两种无毒气体,其离子方程式为2CN-+5H2O2+2H+═N2↑+2CO2↑+6H2O.
,它能与双氧水在酸性条件下反应,生成两种无毒气体,其离子方程式为2CN-+5H2O2+2H+═N2↑+2CO2↑+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时Li+由正极向负极移动 | |
| B. | M可能为羧酸、醇等含活泼氢的有机物 | |
| C. | 充电时的阳极反应为LixC-xe-=C+xLi+ | |
| D. | 钾离子电池的比能量(单位质量释放的能量)低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com