B
分析:A、铁离子水解生成氢氧化铁和氢离子,溶液中离子数增多;
B、锌和氯化氢的量不能确定,依据化学反应生成氢气计算电子转移;
C、依据n=

,结合分子式计算电子数;
D、NaHSO
4和KHSO
3的摩尔质量相同,120g混合物依据n=

,计算得到物质的量,硫酸氢钠是钠离子和硫酸氢根离子构成,亚硫酸氢钾是钾离子和亚硫酸氢根离子构成;
解答:A、0.1mol/L的100mL FeCl
3溶液中,Fe
3++3H
2O?Fe(OH)
3+3H
+,含有的离子数大于0.04N
A,故A错误;
B、标准状况下,将m
1克锌加入到m
2克20%的盐酸中放出nLH
2,锌和氯化氢的量不能确定,依据化学反应生成氢气计算,2H
+~H
2~2e
-,转移电子数

×2×N
A=

,故B正确;
C、9gD
2O物质的量=
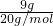
=

,分子中含有的电子数=

×10×N
A=4.5N
A ,故C错误;
D、NaHSO
4和KHSO
3的摩尔质量相同为120g/mol,120g由NaHSO
4和KHSO
3物质的量为1mol,硫酸氢钠是钠离子和硫酸氢根离子构成,亚硫酸氢钾是钾离子和亚硫酸氢根离子构成;,组成的混合物中共含有2N
A的阴阳离子,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的应用,主要考查盐类水解生成两种数的特征,气体摩尔体积的条件应用,氧化还原反应电子转移,混合物的组成特征分析,题目难度中等.

 ,结合分子式计算电子数;
,结合分子式计算电子数; ,计算得到物质的量,硫酸氢钠是钠离子和硫酸氢根离子构成,亚硫酸氢钾是钾离子和亚硫酸氢根离子构成;
,计算得到物质的量,硫酸氢钠是钠离子和硫酸氢根离子构成,亚硫酸氢钾是钾离子和亚硫酸氢根离子构成; ×2×NA=
×2×NA= ,故B正确;
,故B正确;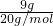 =
= ,分子中含有的电子数=
,分子中含有的电子数= ×10×NA=4.5NA ,故C错误;
×10×NA=4.5NA ,故C错误;
