
【题目】从H、O、S、K四种元素中选择适当的元素,组成与表中第一行物质类别相同的物质,将其化学式天子表中相应空格内
示例 | HN03 | NaOH | Na2CO3 | CO2 |
化学式 |
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.食盐水在电流作用下电离成钠离子和氯离子
B.强电解质的水溶液的导电能力一定比弱电解质的水溶液的导电能力强
C.电解质溶液中已电离出的离子和未电离的分子可以共存
D.电解质溶液的导电过程,与金属导体相同,都是物理过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一条件下,把物质A,B按一定比例充入容积为2L的球开容器,发生如下反应:
2A(g)+B(g)![]() 2C(g);△H=-180KJ.mol-1
2C(g);△H=-180KJ.mol-1
(1) 写出该反应的化学平衡常数表达式 K=__________________
(2)降低温度,该反应K值_________,A转化率____________,化学反应速度________(以上均填“增大,减小或不变”)
(3) 若平均每分钟生成0.5mol的C,则此反应速率可表示为V(C)=__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1molM和1molN气体充入2L恒容密闭容器,发生反应M(g)+ N(g)![]() xP(g)+Q(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体P的浓度随时间变化如图所示。
xP(g)+Q(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体P的浓度随时间变化如图所示。
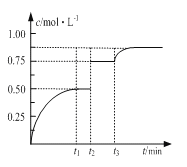
下列说法正确的是
A. 反应方程式中的x=1
B. t2时刻改变的条件是使用催化剂
C. t3时刻改变的条件是移去少量物质Q
D. t1~t3间该反应的平衡常数均为4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是短周期元素,其部分性质如下表:
W | 单质是淡黄色固体 |
X | 在地壳中的含量居第二位 |
Y | 原子最外层电子数是电子总数的2/3 |
Z | 第3周期原子半径最小的金属 |
下列说法正确的是
A. 气态氢化物的热稳定性:X>W
B. 非金属性:Y < W;离子半径:Z > W
C. W在空气中充分燃烧所得产物,可用于杀菌消毒
D. 金属Z与少量NaOH溶液反应,生成两性氢氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知镓和铝在周期表中位于同一纵行,氮化镓可把手机信号扩大10倍,让电脑的速度提高1万倍,将CD缩减到1英寸,下列有关氮化镓的说法中正确的是( )
A.氮化镓是由主族元素与副族元素形成的化合物
B.镓元素比铝元素金属性弱
C.氮化镓中氮元素显+3价
D.氮原子最外层比镓原子最外层多2个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E,F,G为7种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下,其中:B的离子半径大于E的离子半径;D是由极性键构成的4原子分子;C与F可形成D和G分子。
微粒 | A | B | C | D | E | F | G |
原子核数 | 单核 | 单核 | 多核 | 多核 | 单核 | 多核 | 多核 |
电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
(1)A粒子的结构示意图是_________。
(2)用电子式表示D的形成过程: ________________________
(3)比较B与E相应元素的最高价氧化物对应水化物的碱性强弱,为______>_______(用化学式表示)。
(4)D与G反应的化学方程式是_________________。
(5)C粒子是_________,F粒子是_________(用电子式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com