
A、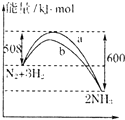 表示的热化学方程式为:N2(g)+3H2(g)═2NH3(g);△H=-92kJ.mol-1 表示的热化学方程式为:N2(g)+3H2(g)═2NH3(g);△H=-92kJ.mol-1 |
B、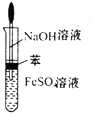 表示实验室中制取Fe(OH)2沉淀,可以防Fe(OH)2被氧比 表示实验室中制取Fe(OH)2沉淀,可以防Fe(OH)2被氧比 |
C、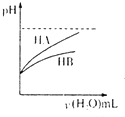 表示常温下稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB 表示常温下稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB |
D、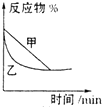 表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 |


科目:高中化学 来源: 题型:
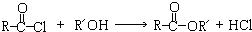
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:

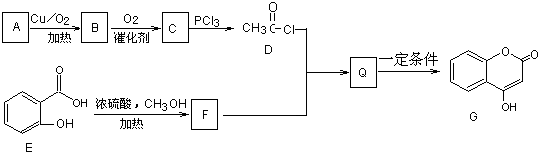
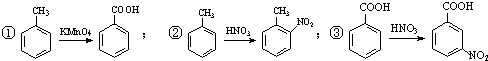
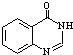 .合成过程中无机试剂任选;合成路线流程图示例为:CH3CH2OH
.合成过程中无机试剂任选;合成路线流程图示例为:CH3CH2OH| H2SO4 |
| 170℃ |
| Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 元素X、Y、Z、Q、W原子序数依次增大,其中X、Y、Z、Q为短周期元素.Z元素的焰色反应为黄色;X与Y形成的气体能使酚酞溶液变红,X与Q形成18电子的分子,
元素X、Y、Z、Q、W原子序数依次增大,其中X、Y、Z、Q为短周期元素.Z元素的焰色反应为黄色;X与Y形成的气体能使酚酞溶液变红,X与Q形成18电子的分子,查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 用中和滴定法测定某烧碱样品的纯度.有以下步骤:
用中和滴定法测定某烧碱样品的纯度.有以下步骤:| 测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑤ | B、③④⑤ |
| C、②⑥ | D、②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、油脂属于酯类 |
| B、油脂的氢化又叫油脂的硬化 |
| C、淀粉和纤维素的通式都是(C6H10O5)n,是同分异构体 |
| D、葡萄糖能发生银镜反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com