
 向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的PH>7.
向100mL 3mol/L的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的PH>7.分析 (1)CO2与NaOH反应可生成Na2CO3或NaHCO3,二者溶液都呈碱性;如果是多种成分,可能是二者混合物,也可能NaOH有剩余;
(2)①加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,A→C段发生
NaHCO3+HCl═NaCl+H2O+CO2↑,而O→A段消耗的盐酸为A→B消耗的盐酸的二倍,应为NaOH和Na2CO3的混合物,都可与盐酸反应,据此写出反应的离子方程式;AB段碳酸氢根离子与氯化氢反应生成二氧化碳气体;
②根据AB段消耗氯化氢溶液的体积及氯化氢的浓度计算出生成二氧化碳的物质的量及标况下的体积;
③AB段发生反应为NaHCO3+HCl═NaCl+H2O+CO2↑,根据氢氧化钠的物质的量计算出溶质氯化钠的浓度.
解答 解:(1)CO2与NaOH反应可生成Na2CO3或NaHCO3,二者溶液都呈碱性,则如果是单一成分,可能是
Na2CO3或NaHCO3,如果是多种成分,若1<$\frac{n(NaOH)}{n(CO2)}$<2,溶质是NaHCO3、Na2CO3.若$\frac{(NaOH)}{n(CO2)}$>2,溶质是Na2CO3、NaOH,
故答案为:Na2CO3或NaHCO3;NaOH和Na2CO3或Na2CO3和NaHCO3;
(2)①加入盐酸200mL时开始生成气体,当加入盐酸300mL时不再产生气体,A→C段发生NaHCO3+HCl═NaCl+H2O+CO2↑,而O-A段消耗的盐酸为A→B的二倍,反应产物应为NaOH和Na2CO3的混合物,二者都可与盐酸反应,反应的离子方程式分别为:OH-+H+═H2O、CO32-+H+═HCO3-;
故答案为:OH-+H+═H2O;CO32-+H+═HCO3-;
②根据反应方程式CO32-+H+═HCO3-、HCO3-+H+=CO2↑+H2O可知,碳酸钠消耗盐酸的体积为100mL,则氢氧化钠消耗的盐酸体积也是100mL,即Na2CO3与NaOH的物质的量相等,根据钠离子守恒,则碳酸钠的物质的量为:$\frac{1}{3}$×(3mol/L×0.1L)=0.1mol,根据碳原子守恒,反应生成二氧化碳的物质的量为0.1mol,标况下0.1mol二氧化碳的体积为:22.4L/mol×0.1mol=2.24L=2240mL,
故答案为:2240;
③B点时溶质为氯化钠,根据氢氧化钠的物质的量可知NaCl的物质的量为:0.1L×3mol/L=0.3mol,
则NaCl的物质的量浓度是:$\frac{0.3mol}{0.3+0.1L}$=0.75mol/L,
故答案为:0.75.
点评 本题考查混合物的计算,题目难度中等,注意从图象分析反应可能的情况进行判断和计算,本题关键是根据图象判断溶液溶质的成分,注意在计算过程中守恒思想的应用.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
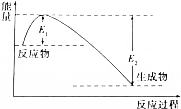 如图所示的是1molNO2和足量的CO完全反应生成CO2和NO过程中的能量变化示意图,能够表示出CO2+NO=NO2+CO的能量变化示意图的是( )
如图所示的是1molNO2和足量的CO完全反应生成CO2和NO过程中的能量变化示意图,能够表示出CO2+NO=NO2+CO的能量变化示意图的是( )| A. | 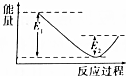 | B. | 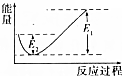 | C. | 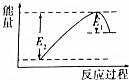 | D. | 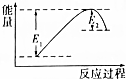 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
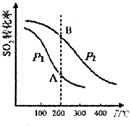 研究硫酸工业原理及含硫化合物的性质具有重要意义.
研究硫酸工业原理及含硫化合物的性质具有重要意义.| 气体 | SO2 | O2 | SO3 |
| 浓度(mol•L-1) | 0.4 | 1.2 | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则含1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +184.6KJ•mol-1 | B. | 92.3KJ•mol-1 | C. | -369.2KJ•mol-1 | D. | +92.3KJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com